
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 30 | 120 | 280 | 350 | 370 |


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
| A、乙烷、乙醇、乙二醇 |
| B、苯、苯酚、苯乙烯 |
| C、甲醛、乙酸、甲酸甲酯 |
| D、甲烷、乙烯、乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 混合溶液 |
A | B | C | D | E | F |
| 4mol?L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 盐酸浸泡 |
| 过滤 |
| 氧化处理 |
| 足量的 |
| NaOH溶液 |
| 过滤 |
| 洗涤 |
| 煅烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | ||||
| 4 | B | H |
查看答案和解析>>
科目:高中化学 来源: 题型:
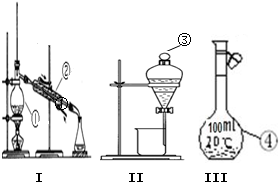 (1)写出下图中序号①~③仪器的名称:
(1)写出下图中序号①~③仪器的名称: 请回答下列问题:
请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com