
| A. | 强弱电解质的区别是溶液的导电能力大小 | |
| B. | 溶液与胶体的本质区别是有无丁达尔效应 | |
| C. | 相同条件下,等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| D. | 约含6.02×1023个Na+的Na2O2投入水中配成1L溶液,Na+的物质的量浓度为1mol/L |
分析 A、强弱电解质的本质区别是电离程度;
B、溶液、胶体和浊液的本质区别是分散质粒子直径的大小;
C、等质量的硫蒸汽的能量高于固体硫的能量;
D、6.02×1023个Na+的物质的量为1mol.
解答 解:A、强弱电解质的本质区别是电离程度,与溶解度、离子浓度和导电能力无关,故A错误;
B、溶液、胶体和浊液的本质区别是分散质粒子直径的大小,而不是丁达尔效应,丁达尔效应只是胶体特有的性质,故B错误;
C、等质量的硫蒸汽的能量高于固体硫的能量,故当完全燃烧得到的产物相同时,硫蒸汽放出的热量更多,故C错误;
D、过氧化钠中含有的6.02×1023个Na+的物质的量为1mol,将过氧化钠投入水中后钠离子守恒,即所得的1L溶液中钠离子仍为1mol,故浓度为1mol/L,故D正确.
故选D.
点评 本题考查了强弱电解质的本质区别以及分散系的本质区别,应注意的是强弱电解质与电解质的溶解度、离子浓度和导电能力无关,本质区别是电离程度.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 向Ca(HCO3)2溶液加入过量的NaOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| B. | 向NH4HCO3溶液中滴入少量NaOH溶液:NH4++OH-═NH3•H2O | |
| C. | FeSO4溶液在空气中变黄色:4Fe2++O2+4H+═4Fe3++2H2O | |
| D. | 用NaOH溶液吸收NO2气体:3NO2+2NaOH═2NaNO3+NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
| 平 衡 时 数 据 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | akJ | bkJ | ckJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
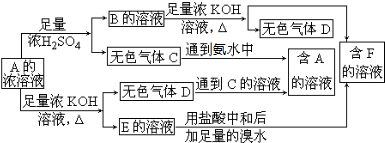
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
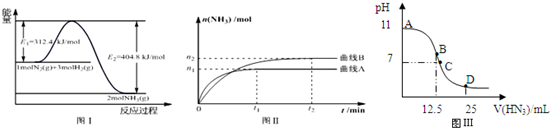
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com