
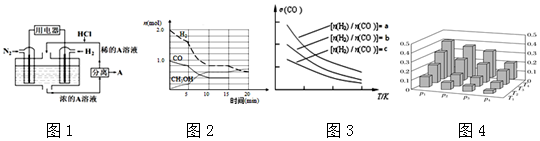
分析 (1)电池中氢气失电子,在负极发生氧化反应,氮气得电子在正极发生还原反应,氨气与HCl反应生成氯化铵,则电解质溶液为氯化铵;
(2)①10min时反应到达平衡,平衡时CO为0.4mol、甲醇为0.6mol、氢气为0.8mol,根据v=$\frac{△c}{△t}$计算v(CO),根据K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$计算平衡常数;
②5min时刻瞬间各组分的物质的量未变,而后反应速率加快,可能是使用了催化剂或增大压强;
③增大H2的浓度,平衡右移,CO的转化率增大;
④根据图2温度升高CO的转化率降低分析判断;
⑤A.增大反应物浓度,平衡正向移动,正反应速率先增大后减小;
B.逆反应速率先增大后减小,说明平衡逆向移动;
C.化学平衡常数K值增大,说明平衡正向移动;
D.反应物的体积百分含量增大,可以增大反应物浓度市平衡正向移动;
E.移走生成物的量,平衡正向移动,混合气体总质量减小,容器容积不变,混合气体密度减小;
F.增大氢气的物质的量,平衡正向移动,但氢气转化率减小;
(3)①溶液的酸碱性是根据溶液中H+浓度与OH-浓度的相对大小判断的,只要溶液中c(H+)=c(OH-),溶液就呈中性,CH3COOH是弱电解质,电离程度不大,NaOH是强电解质,完全电离,反应生成的乙酸钠是强碱弱酸盐水解呈碱性,需溶液呈中性,需少加碱;
②呈中性则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=0.5bmol/L,由物料守恒可知c(CH3COOH)=0.5(a-b)mol/L,再根据电离常数Ka=$\frac{c({H}^{+})×c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$计算;
解答 解:(1)该电池的本质反应是合成氨反应,电池中氢气失电子,在负极发生氧化反应,氮气得电子在正极发生还原反应,则正极反应式为N2+8H++6e-=2NH4+,氨气与HCl反应生成氯化铵,则电解质溶液为氯化铵溶液,
故答案为:N2+8H++6e-=2NH4+;氯化铵;
(2)①10min时反应到达平衡,平衡时CO为0.4mol、甲醇为0.6mol、氢气为0.8mol,
则v(CO)=$\frac{\frac{1mol-0.4mol}{2L}}{10min}$=0.03mol/(L.min),平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{\frac{0.6}{2}}{\frac{0.4}{2}×(\frac{0.8}{2})^{2}}$=9.375,
故答案为:0.03mol/(L.min);9.375;
②5min时刻瞬间各组分的物质的量未变,而后反应速率加快,可能是使用了催化剂或增大压强,
故答案为:使用了催化剂或增大压强;
③增大H2的浓度,平衡右移,CO的转化率增大,故有a>b>c,故答案为:a>b>c;
④通过图2可知,温度升高CO的转化率降低,说明升温平衡逆向移动,故正反应方向为放热反应,则温度越高二甲醚的质量分数越小,故温度:T1>T2>T3>T4;
正反应为气体体积减小的反应,增大压强平衡正向移动,二甲醚的质量分数增大,故压强P1>P2>P3>P4,
故答案为:T1>T2>T3>T4;P1>P2>P3>P4;在其他条件不变情况下,该反应正反应是个气体系数减小的反应,压强越大,平衡正移,甲醇的物质的量分数越大,故P1>P2>P3>P4;
⑤A.增大反应物浓度,平衡正向移动,正反应速率先增大后减小,不一定逆向移动,故A错误;
B.逆反应速率先增大后减小,说明平衡逆向移动,故B正确;
C.化学平衡常数K值增大,说明平衡正向移动,故C错误;
D.反应物的体积百分含量增大,可以减小压强平衡逆向移动,故D正确;
E.移走生成物的量,平衡正向移动,混合气体总质量减小,容器容积不变,混合气体密度减小,故E错误;
F.增大氢气的物质的量,平衡正向移动,但氢气转化率减小,故F错误,
故选:BD;
(3)①CH3COOH是弱电解质,电离程度不大,NaOH是强电解质,完全电离,反应生成的乙酸钠是强碱弱酸盐,水解呈碱性,需溶液呈中性pH=7,需少加碱,所以常温下,将V mL、0.1000mol•L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol•L-1醋酸溶液中,充分反应,V<20.00mL溶液呈中性pH=7,c(H+)=c(OH-);故答案为:<;
②呈中性则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=0.5bmol/L,由物料守恒可知c(CH3COOH)=0.5(a-b)mol/L,则CH3COOH的电离常数Ka=$\frac{c({H}^{+})×c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=$\frac{1{0}^{-7}×0.5b}{0.5(a-b)}$=$\frac{1{0}^{-7}b}{a-b}$,
故答案为:$\frac{1{0}^{-7}b}{a-b}$.
点评 本题考查化学平衡图象、平衡状态建立、平衡移动等,对学生综合能力考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下44.8L乙醇(C2H5OH)含有氢原子数为12NA | |
| B. | 25°C,101KPa条件下,1.4g N2的体积大于1.12L | |
| C. | 22g某气体含分子数为0.5NA,则其摩尔质量为44 | |
| D. | 标准状况下1.12L CO和 N2的混合气体含有约3.01×1022个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5 | B. | 5.5 | C. | 9 | D. | 11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
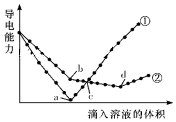 在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析正确的是( )
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析正确的是( )| A. | ②代表滴加H2SO4溶液的变化曲线 | |
| B. | b点溶液中大量存在的离子是SO42-、Na+、OH- | |
| C. | a、d两点对应的溶液均显中性 | |
| D. | c点两溶液中含有相同量的OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Z>W | |
| B. | 对应的氢化物的热稳定性:R>W | |
| C. | X与Z、W与Z均以原子个数比1:1形成的化合物中化学键类型不完全相同 | |
| D. | R的最高价氧化物的水化物与NaHYO3溶液反应有气泡生成,证明非金属性:R>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Fe3+、Cl- | B. | Na+、CO32-、H+ | C. | Na+、HCO3-、OH- | D. | K+、AlO2-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压,22.4 SO3中的硫原子数目大于NA | |
| B. | 50g质量分数为34%的过氧化氢水溶液中含氧原子数目为NA | |
| C. | 5.6g Fe在0.1mol Cl2中充分燃烧,转移的电子数为0.3NA | |
| D. | 0.2mol AlCl3中含离子数为0.8NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com