
某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质的成分。
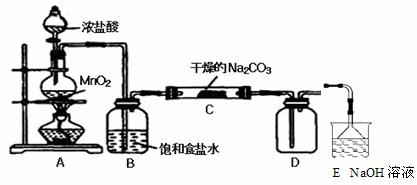
向C装置中通入一定量的氯气后,测得只生成一种气体Cl2O。可以确定的是C得到的固体最多含有三种物质,含有氯元素的盐只有一种,且一定含有NaHCO3,现对C中得到的固体成分进行猜想和验证。
①提出合理猜想:一定含有NaHCO3和 ;可能含有剩余的Na2CO3。
②设计方案,进行成分检验:
请完成实验步骤3、4以及预期现象和结论并将答案填入下表的相应空格内。
限选实验试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、品红、稀盐酸
| 实 验 步 骤 | 预 期 现 象 和 结 论 |
| 步骤1:取C中的少量固体样品于试管中,加入蒸馏水至固体溶解,然后各取1~2mL所得溶液分别置于甲、乙两支试管中。 | 得到无色溶液 |
| 步骤2:向甲试管中加入过量的BaCl2溶液,静置。 | 若溶液变浑浊,证明固体中含有 。 |
| 步骤3:取甲试管中上层清液少许于另一只试管中,滴加少量 ,充分振荡。 | 若 , 证明固体中含有NaHCO3 。 |
| 步骤4:向乙试管中先加入过量的 , 再滴入少量 溶液。 | 若生成白色沉淀;证明固体中含有______。 |
科目:高中化学 来源: 题型:
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素基态原子核外电子排布式为________,该元素的名称是________。
(2)Y元素原子价电子排布图为 。
(3)X与Z可形成化合物XZ3,该化合物的空间构型为________。
(4)已知由元素X与镓元素组成的化合物A为第三代半导体。已知化合物A的晶胞结构与金刚石相似,其中X原子位于立方体内,镓原子位于立方体顶点和面心,请写出化合物A的化学式 ;化合物A可由(CH3)3Ga和XZ3在700℃下反应制得,反应的化学方程式为 。
(5)已知铝与镓元素位于同一主族,金属铝属立方晶系,其晶胞边长为405 pm,密度是2.70g·cm-3,通过计算确定其晶胞的类型 (填简单、体心或面心立方);晶胞中距离最近的铝原子可看作是接触的,计算铝的原子半径r(A1)= pm。(列出算式即可,已知:4053≈6.64×107)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质分类或归纳正确的是
①混合物:盐酸、漂白粉、水玻璃、水银
②化合物:BaCl2、Ca(OH)2、HNO3、HT
③电解质:明矾、冰醋酸、氯化银、纯碱
④同素异形体:金刚石、石墨、C60、C70
A.①② B.②③ C.③④ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
A.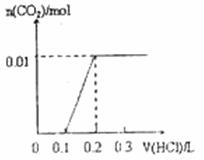 B.
B.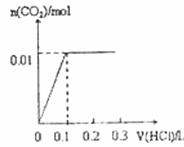
C.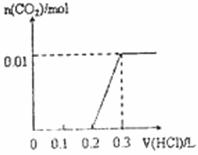 D.
D.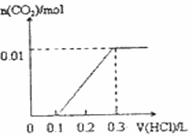
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是
A.向碳酸氢钠溶液中滴入氢氧化钠 HCO3-+OH-=CO32-+H2O
B.向碳酸氢钾溶液中滴入过量澄清石灰水 2HCO3-+Ca2++2OH-=CO32-+2H2O+CaCO3↓
C.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2++OH-+H++SO42- ==BaSO4↓+H2O
D.硫酸铜和氢氧化钡溶液混合SO42-+Ba2+=+BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是
A.电解饱和食盐水可制取烧碱、氯气、氢气
B.从海水中可提取镁、溴、碘等物质
C.粗铜(含少量Zn、Fe、Pt等)电解精炼后,溶液中金属阳离子只有Fe2+、Zn2+
D.在镀件上镀铜,镀件作阴极
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z均由短周期元素组成的中学常见物质,存在如下转化关系:
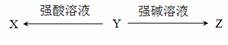 ,下列说法错误的是
,下列说法错误的是
A.Y可能是氧化物
B.Y可能是盐类
C.若X、Z是同一物质,则可能是乙醇
D.Y→X、Y→Z不可能同时为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下面是某化 学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )
学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )
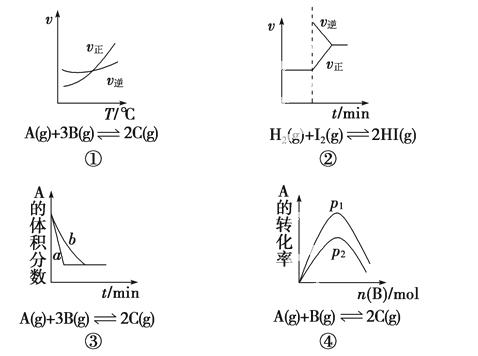
A.①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0
B.②是缩小容积体积后化学反应速率随时间变化的图像
C.③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D.④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
查看答案和解析>>
科目:高中化学 来源: 题型:
乙醇是重要的有机化工原料,可由乙烯直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H)。再水解生成乙醇。写出相应的反应的化学方程式
(2)已知:
甲醇脱水反应①2CH3OH(g)=CH3OCH3(g)+H2O(g)△H1=-23.9KJ·mol-1
甲醇制烯烃反应②2CH3OH(g)=C2H4 (g)+2H2O(g) △H2=-29.1KJ·mol-1
乙醇异构化反应③CH3CH2OH(g)=CH3OCH3(g)) △H3=+50.7KJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的△H= KJ·mol-1
与间接水合法相比,气相直接水合法的优点是: 。
(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中n(H2O)︰n(C2H4)=1︰1)
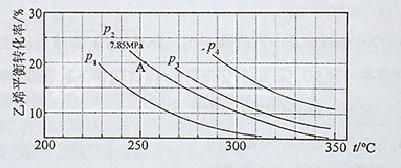
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数K= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②图中压强P1、P2、P3、P4的大小顺序为: ,理由是:
③气相直接水合法党采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290 ℃,压强6.9MPa,n(H2O)︰n(C2H4)=0.6︰1。乙烯的转化率为5℅。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有: 、 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com