
分析 (1)有些化合反应是吸热反应,如碳和二氧化碳反应制一氧化碳,其它反应都是放热反应;
(2)物质含有的能量越高,物质的稳定性越差,根据A与B的转化过程中能量变化比较二者的稳定性;
(3)根据非金属元素的原子获得相同数目的电子放出热量越多,生成的阴离子越稳定,原子的非金属性越强,氧化性越强来分析;
(4)等质量的硫蒸气具有的能量比硫固体多;
(5)物质具有的能量越低越稳定,越活泼的物质能量越高,从这个角度分析;
(6)根据旧键断裂吸收的能量减去新键生成释放的能量值即为反应热解答,燃烧反应为放热反应.
解答 解:(1)形成化学键、燃料的燃烧、葡萄糖在体内的氧化分解、酸碱中和反应和炸药的爆炸过程都属于放热反应,而化合反应不一定为放热反应,如二氧化碳与C的反应属于吸热反应,所以不一定释放能量的为C,
故答案为:C;
(2)A和B是同种元素的两种单质,A转化为B时需吸收能量,说明A的能量低于B,能量越低越稳定,所以稳定性A的强于B,
故答案为:A;
(3)非金属元素的原子获得相同数目的电子放出热量越多,生成的阴离子越稳定,原子的非金属性越强,由此可知:X的非金属性比Y的强,
故答案为:X;
(4)等质量的硫蒸气和硫固体相比较,硫蒸气具有的能量多,因此完全燃烧硫蒸气放出的热量多,
故答案为:B;
(5)物质具有的能量越低越稳定,越活泼的物质能量越高,Cl、Br在同一主族,元素的非金属性逐渐减弱,其对应单质的氧化性逐渐减弱,在Cl2、Br2中,Cl2活泼,所以Cl2、Br2两种物质与等物质的量的氢气反应时,Cl2放出的热量最多,
故答案为:Cl2;
(6)1molH2O中含2molH-O键,断开1molH-H、1molO=O、1molO-H键需吸收的能量分别为Q1、Q2、Q3kJ,则成1molO-H键放出Q3kJ热量,对于反应H2(g)+$\frac{1}{2}$O2(g)=H2O(g),断开1molH-H键和$\frac{1}{2}$molO=O键所吸收的能量Q1+$\frac{1}{2}$Q2,生成新键释放的能量2Q3,该反应放热,(Q1+$\frac{1}{2}$Q2)-2Q3<0,即2Q1+Q2<4Q3,
故答案为:C.
点评 本题考查了化学反应与能量变化,注意掌握吸热反应与放热反应的概念,物质稳定性与物质能量大小之间关系,灵活运用元素周期律的递变规律,1molH2O中含2molH-O键为解答易错点,题目难度适中.


科目:高中化学 来源: 题型:填空题
 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y、Z、W三种元素组成化合物的化学式可能为ZWY | |
| B. | Z与Y、Z与W形成的化合物的化学键类型可能完全相同 | |
| C. | 简单离子的半径:R>W>Y>Z | |
| D. | 因非金属性Y>R,所以X与Y组成化合物的沸点低于X与R组成的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
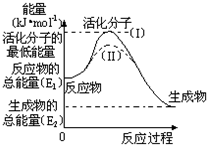 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol-1表示.请认真观察如图,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol-1表示.请认真观察如图,然后回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na与水反应时增大水的用量 | |
| B. | 恒温恒容条件下,在工业合成氨反应中,增加氮气的量 | |
| C. | 在H2SO4与NaOH两溶液反应时,增大压强 | |
| D. | 将稀H2SO4改为98%的浓H2SO4与Zn反应制取H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一.在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒.除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3═Cu(NH3)3(CO)Ac.
合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一.在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒.除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3═Cu(NH3)3(CO)Ac.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCl2晶体中的化学键是离子键 | |
| B. | 某物质在熔融态能导电,则该物质中一定含有离子键 | |
| C. | H2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 干冰是分子晶体,其溶于水生成碳酸的过程只需克服分子间作用力 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com