
(16分)中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1) 将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH | SO | NO | Cl- |
浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据计算PM2.5待测试样的pH = 。
(2) NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下: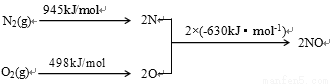
① N2(g)+O2(g) 2NO(g) △H= 。
2NO(g) △H= 。
②当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式 。
(3) 碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
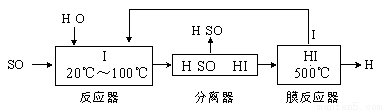
①用离子方程式表示反应器中发生的反应 。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是_____________________。
③用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为:Ni(OH)2+M NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。
NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。
(1)4 (3分) (2)①+183 kJ·mol-1 (3分) ②2NO+2CO 2CO2+N2(2分)
2CO2+N2(2分)
(3)①SO2+I2+2H2O=SO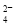 +2I-+4H+(2分)②HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行(2分) ③ MH+OH--e-=H2O+M(2分) O2+4e-+2H2O=4OH-(2分)
+2I-+4H+(2分)②HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行(2分) ③ MH+OH--e-=H2O+M(2分) O2+4e-+2H2O=4OH-(2分)
【解析】
试题分析:(1)在溶液中阳离子所带的正电荷总数与阴离子所带的负电荷总数相等。阴离子所带的负电荷总数是:2c(SO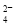 )+c(NO
)+c(NO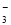 )+c(Cl-)=2×4×10-5+1×3×10-5+1×2×10-5=1.3×10-4mol/L,阳离子所带的正电荷总数是:c(K+)+c(Na+)+c(NH4+)=4×10-6+6×10-6+2×10-5=3×10-5 mol/L<1.3×10-4mol/L,因此溶液显酸性,c(H+)=1.3×10-4mol/L-3×10-5 mol/L=1×10-4mol/L,所以pH=4;(2) ① N2(g)+O2(g)
)+c(Cl-)=2×4×10-5+1×3×10-5+1×2×10-5=1.3×10-4mol/L,阳离子所带的正电荷总数是:c(K+)+c(Na+)+c(NH4+)=4×10-6+6×10-6+2×10-5=3×10-5 mol/L<1.3×10-4mol/L,因此溶液显酸性,c(H+)=1.3×10-4mol/L-3×10-5 mol/L=1×10-4mol/L,所以pH=4;(2) ① N2(g)+O2(g)  2NO(g) △H=+945 kJ/mol+498kJ/mol-2×630 kJ/mol=+183 kJ/mol;②NO被CO还原的化学方程式是2NO+2CO
2NO(g) △H=+945 kJ/mol+498kJ/mol-2×630 kJ/mol=+183 kJ/mol;②NO被CO还原的化学方程式是2NO+2CO 2CO2+N2;(3)①SO2和I2在溶液中发生反应产生硫酸和氢碘酸,用离子方程式表示是SO2+I2+2H2O=SO
2CO2+N2;(3)①SO2和I2在溶液中发生反应产生硫酸和氢碘酸,用离子方程式表示是SO2+I2+2H2O=SO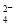 +2I-+4H+;②HI分解为氢气和I2的反应是可逆反应,若及时分离出产物H2,有利于反应正向进行从而可以提高H2的产率;③根据电池的总方程式可知:电池放电时,在负极MH失去电子形成的H+与溶液中的OH-结合形成水,电极反应式为MH+OH--e-=H2O+M;在阴极上氧气得到电子形成OH-;电极反应式为O2+4e-+2H2O=4OH-。
+2I-+4H+;②HI分解为氢气和I2的反应是可逆反应,若及时分离出产物H2,有利于反应正向进行从而可以提高H2的产率;③根据电池的总方程式可知:电池放电时,在负极MH失去电子形成的H+与溶液中的OH-结合形成水,电极反应式为MH+OH--e-=H2O+M;在阴极上氧气得到电子形成OH-;电极反应式为O2+4e-+2H2O=4OH-。
考点:考查溶液中的电荷守恒、热化学方程式的书写、氧化还原反应方程式的书写、影响化学平衡的因素、原电池、电解池的反应原理及应用的知识。


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源:2015届贵州省贵阳市高三年级8月摸底考试化学试卷(解析版) 题型:选择题
在密闭容器中A与B反应生成C,其反应速率分别为 、
、 、
、 表示。已知: 2
表示。已知: 2 =3
=3 ,3
,3 =2
=2 ,则此反应可表示为( )
,则此反应可表示为( )
A.2A+3B=2C B.A+3B=2C C.3A+B=2C D.A+B=C
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:填空题
某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验:(已知:硅不与盐酸和水反应)
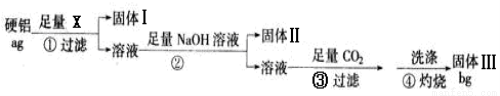
(1)若固体Ⅰ中含有铜和硅,步骤①的试剂X应选择 (填“NaOH溶液”,“盐酸”,“FeCl3溶液”);步骤②的操作是 ,反应的离子方程式为 , 。
(2)固体Ⅲ的化学式为 步骤④反应的化学方程式为 。
(3)步骤④中的沉淀没有用蒸馏水洗涤时,会使测定结果 (填“偏高”“偏低”“不影响”)
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在溶液中一定能大量共存的是
A.pH=12的溶液:K+、Na+、CH3COO—、CO23—
B.0.1 mol/L的NaNO3溶液:H+、Fe2+、Cl—、SO42—
C.与铝反应产生大量氢气的溶液:Mg2+、K+、HCO3—、NO3—
D.由水电离产生的c(H+)=10-13mol/L的溶液:NH4+、Ca2+、SO32—、Cl—
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
NA为阿伏伽德罗常数,下列叙述错误的是
A.标准状况下,11. 2 L氦气中含有0.5 NA原子
B.常温常压下,46g NO2和N2O4混合气体中含有原子总数为3NA
C.标准状况下,0.1 mol Cl2参加反应,转移的电子数目一定为0. 2 NA
D.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移电子总数NA个
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第二次质量检查化学试卷(解析版) 题型:选择题
如图所示,X、Y、Z为短周期元素,且X、Z的核外电子数之和等于Y的核外电子数,下列说法不正确的是

A.三种元素中,Z元素原子半径最小
B.X、Y 两种元素的气态氢化物能相互反应
C.Z位于元素周期表中第2周期、第ⅥA族
D.Y元素的气态氢化物与X 的最高价氧化物对应的水化物能发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
如图所示是向MgCl2和AlCl3的混合溶液中加入一定量NaOH溶液,紧接着再加入一定量稀盐酸,生成沉淀的物质的量y与加入溶液的体积x的关系图。根据图示判断,下列结论中不正确的是( )。

A.N点时溶液中的溶质只有NaCl
B.M点之前加入的是NaOH溶液,M点之后加入的是盐酸
C.c(NaOH)=c(HCl)
D.原混合溶液中c(MgCl2)∶c(AlCl3)=1∶1
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.云、雾、烟都属于胶体,其分散剂都是空气
B.新制氯水中的所有物质都是电解质
C.水晶项链和餐桌上的瓷盘都是硅酸盐制品
D.制造光导纤维的原料是晶体硅
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第一次阶段考试化学试卷(解析版) 题型:选择题
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是( )
A.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g
B.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色
C.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色
D.该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com