
【题目】硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号________________ ,该能层具有的原子轨道数为________________、电子数为________________。
(2)硅主要以硅酸盐、________________等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以________________相结合,其晶胞中共有8个原子,其中在面心位置贡献________________个原子。
(4)单质硅可通过甲硅烷(SiH4) 分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为________________。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:

硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是___________。SiH4的稳定性小于CH4,更易生成氧化物,原因是 ________________。
(6)在硅酸盐中,SiO44+四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根;其中Si原子的杂化形式为________________。Si与O的原子数之比为 ________________ 化学式为________.

【答案】M 9 4 二氧化硅 共价键 3 Mg2Si + 4NH4Cl = SiH4+ 4NH3+ 2MgCl2 C—C键和C—H键较强,所形成的烷烃稳定。而硅烷中Si—Si键和Si—H键的键能较低,易断裂,导致长链硅烷难以生成 C—H键的键能大于C—O键,C—H键比C—O键稳定。而Si—H键的键能却远小于Si—O键,所以Si—H键不稳定而倾向于形成稳定性更强的Si—O键 sp3 1∶3 [SiO3] n2n-(或SiO32-)
【解析】
试题
(1)硅原子核外有14个电子,其基态原子的核外电子排布式为1s22s22p63s23p2 ,对应能层分别别为K、
L、M,其中能量最高的是最外层M层,该能层有s、p、d三个能级,s能级有1个轨道,p能级
有3个轨道,d能级有5个轨道,所以共有9个原子轨道,硅原子的M能层有4个电子(3s23p2)。
故答案为:M;9;4;
(2)硅元素在自然界中主要以化合态(二氧化硅和硅酸盐)形式存在。
故答案为:二氧化硅;
(3)硅晶体和金刚石晶体类似都属于原子晶体,硅原子之间以共价键结合;硅晶胞中每个顶点上有1
个Si、面心是有1个Si、在晶胞内部含有4个Si原子,利用均摊法知,面心提供的硅原子个数
=6×![]() =3。
=3。
故答案为:共价键;3;
(4)Mg2Si和NH4Cl在液氨介质中反应制得SiH4、NH3和MgCl2,方程式为:Mg2Si+4NH4Cl= SiH4+
4NH3+2MgCl2。
故答案为:Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2;
(5)①烷烃中的C-C键和C-H键大于硅烷中的Si-Si键和Si-H键的键能,所以硅烷中Si-Si键和Si-H
键的键能易断裂,导致长链硅烷难以生成。
故答案为:C-C键和C-H键较强,所形成的烷烃稳定,而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成;
②键能越大、物质就越稳定,C-H键的键能大于C-O键,故C-H键比C-O键稳定,而Si-H键的
键能远小于Si-O键,所以Si-H键不稳定而倾向与形成稳定性更强的Si-O键。
故答案为:C-H键的键能大于C-O键,C-H键比C-O键稳定,而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键;
(6)硅酸盐中的硅酸根(SiO44-)为正四面体结构,所以中心原子Si原子采取了sp3杂化方式;根据图
(b)可以看出,每个结构单元中都有两个氧原子被两个单元共用,所以每个结构单元中相当于含
有1个硅原子、3个氧原子,Si与O的原子数之比为1:3,化学式为SiO32-(或表示为(SiO)n2n-)。
故答案为:sp3;1:3;SiO32-(或表示为(SiO)n2n-)。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某恒定温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g) ![]() 4C(?)+2D(?),“?”代表状态未定。反应一段时间后达到平衡,测得生成1. 6 mol C,且反应前后压强之比为5∶4,则下列说法正确的是
4C(?)+2D(?),“?”代表状态未定。反应一段时间后达到平衡,测得生成1. 6 mol C,且反应前后压强之比为5∶4,则下列说法正确的是
A. 该反应的化学平衡常数表达式是K= c4(C).c2(D)/[c3(A).c2(B)]
B. 此时B的平衡转化率是35%
C. 增大该体系的压强,平衡向右移动,化学平衡常数增大
D. 平衡后再增加1mol C,B的平衡转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C,Si、B,N、Cl在工业生产中具有重要的应用,试回答下列问题:

(1)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过________杂化与周围碳原子成键,多层碳纳米管的层与层之间靠________结合在一起。
(2)现在新开发出一种具有和“龙芯”主要成分一样的六角形笼状结构单质Si12,它可能在未来的量子计算机中是一种理想的贮存信息的材料,根据图示推断这种六角形笼状结构:Si12是____晶体,它与单晶硅互称为________。
(3)SiC晶体结构与金刚石相似,碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能。其中C原子的杂化方式为____________,微粒间存在的作用力是_____________,每个Si原子周围距离最近的C原子为______个,其键角为_________。设晶胞边长为a cm,密度为b g·cm-3,则阿伏加德罗常数可表示为____________________(用含A,b的式子表示)。
(4)氮化硼(BN)是一种重要的功能陶瓷材料,以天然硼砂为起始物,经过一系列反应可以得到BN。由于BN与CC属于等电子体物质,其结构和性质有很大的相似性。
①BN有两种晶体,对BN两种晶体的描述中不正确的是______ 。
A.其中一种晶体可用作耐磨材料
B.其中一种晶体可用作润滑材料
C.其中一种晶体键角为90°
D.其中一种晶体中存在六元环
②在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的作用力为________,层间作用力为__________。B原子和N原子的杂化类型分别是________、__________。
③六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为a cm,立方氮化硼晶胞中含有____个氮原子、_____个硼原子,晶胞顶点上的原子的配位数为______,立方氮化硼的密度是_________g·cm-3(阿伏加德罗常数为NA)。
④立方氮化硼比晶体硅具有更高硬度和耐热性的原因是_____________________________。
(5)已知氮化碳晶体是新发现的高硬度材料,且构成该晶体的微粒间只以单键结合。下列关于该晶体的说法错误的是____________。
A.氮化碳属于原子晶体,比金刚石中的硬度更大
B.该晶体中每个碳原子与4个氮原子相连,每个氮原子与3个碳原子相连,氮化碳的化学式为C3N4
C.该晶体中碳原子和氮原子的最外层都满足8电子结构
D.该晶体与金刚石相似,都是原子间以非极性键形成空间网状结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a,b,c,d为四种由短周期元素构成的中性粒子,它们都有14个电子,且除a外都是共价型分子。回答下列问题:
(1)a是单核粒子,a单质可用作半导体材料,a原子核外电子排布式为______________。
(2)b是双核化合物,常温下为无色无味气体。b的化学式为________。人一旦吸入b气体后,就易引起中毒,是因为__________而中毒。
(3)c是双核单质,写出其电子式____________。c分子中所含共价键的类型为_______(填“极性键”或“非极性键”)。c单质常温下性质稳定,不易起反应,原因是________________________。
(4)d是四核化合物,其结构式为______________;d分子内所含共价键有________个σ键,________个π键;σ键与π键的强度大小关系为σ___π(填“>”、“<”或“=”),原因是:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的化工原料。用CO2催化加氢可制取乙烯:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH<0
C2H4(g)+4H2O(g) ΔH<0

(1)若该反应体系的能量随反应过程变化关系如图所示,则该反应的ΔH=_________kJ·mol1。(用含a、b的式子表示)
(2)几种化学键的键能如表所示,实验测得上述反应的ΔH= 152 kJ·mol1,则表中的x=___________。
化学键 | C=O | H-H | C=C | C-H | O-H |
键能/(kJ·mol-1) | 803 | 436 | x | 414 | 463 |
(3)向1 L恒容密闭容器中通入1 mol CO2和n mol H2,在一定条件下发生上述反应,测得CO2的转化率α(CO2)与反应温度、投料比X[ n(H2)/n(CO2 )]的关系如图所示。

①X1_________(填“>”、“<”或“=”,下同)X2;
②平衡常数KA_______KB,KB________KC;
③若B点时X=3,则平衡常数KB=_____________(代入数据列出算式即可);
④下列措施能同时满足增大反应速率和提高CO2转化率的是(__________)
a.升高温度 b.加入催化剂 c.增大投料比X d.将产物从反应体系中分离出来

(4)以稀硫酸为电解质溶液,利用太阳能电池将CO2转化为乙烯的工作原理如图所示。则N极上的电极反应式为:_______________;该电解池中所发生的总反应的化学方程式为:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷脱氢是工业生产丙烯的重要途径,其热化学方程式为:C3H8(g) ![]() C3H6(g)+H2(g) ΔH。请回答下列相关问题。
C3H6(g)+H2(g) ΔH。请回答下列相关问题。
(1)下表为部分键能数据,据此可算出△H=_________kJ/mol。
化学键 | C—C | C=C | C—H | H—H |
键能(kJ/mol) | 332 | 611 | 414 | 436 |
(2)一定温度下,向2L的密闭容器中充入2molC3H8发生脱氢反应,经过10min达到平衡状态,测得平衡时气体压强是开始的1.4倍。
①0~10 min内氢气的生成速率v(H2)=__________,C3H8的平衡转化率为_________。
②下列情况能说明该反应达到平衡状态的是___________。
A.混合气体的平均分子量保持不变
B. C3H6与H2的物质的量之比保持不变
C.混合气体的密度保持不变
D. C3H8的分解速率与C3H6的消耗速率相等
(3)脱氢反应分别在压强为p1和p2时发生,丙烷及丙烯的平衡物质的量分数随温度变化如图所示。

①压强:p1______p2(填“>”或“<”)。
②为了同时提高反应速率和反应物的平衡转化率,可采取的措施是__________。
③若p1=0.1 MPa,起始时充入丙烷发生反应,则Q点对应温度下,反应的平衡常数Kp_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
④在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氢反应,起始n(氩气)/n(丙烷)越大,丙烷的平衡转化率越大,其原因是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三乙酸锰可作单电子氧化剂,用如下反应可以制取三乙酸锰:
4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn +8HNO2+ 3O2↑+40CH3COOH。
(1)基态锰原子的价层电子排布式为______,基态Mn3+含有的未成对电子数是______。
(2) CH3COOH中碳原子的杂化形式为________。
(3) NO3-的空间构型是________,与NO3-互为等电子体的分子的化学式为__________(任写一种)。
(4) CH3COOH能与H2O以任意比互溶的原因是____________________。
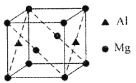
(5)某种镁铝合金可作为储钠材料,该合金晶胞结构如图所示,晶胞棱长为anm,该合金的化学式为_______,晶体中每个镁原子周围距离最近的铝原子数目为_______,该晶体的密度为______g/cm3(阿伏伽德罗常数的数值用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸钴用作催化剂及制钴盐原料,陶瓷工业着色剂,电子、磁性材料的添加剂。利用以下装置测定碱式碳酸钴[Cox(OH)y(CO3)z·H2O]的化学组成。

已知:碱式碳酸钴中钴为+2价,受热时可分解生成三种氧化物。请回答下列问题:
(1)选用以上装置测定碱式碳酸钴[Cox(OH)y(CO3)z·H2O]的化学组成,其正确的连接顺序为a→b→____(按气流方向,用小写字母表示)。
(2)样品分解完,打开活塞K,缓缓通入氮气数分钟,通入氮气的目的是_______________。
(3)取碱式碳酸钴样品34.9 g,通过实验测得分解生成的水和二氧化碳的质量分别为3.6 g、8.8 g,则该碱式碳酸钴的化学式为______________________________。
(4)某兴趣小组以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种实验设计流程如下:

已知:25 ℃时,部分阳离子以氢氧化物形成沉淀时,溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀(pH) | 1.9 | 7.0 | 7.6 | 3.4 |
完全沉淀(pH) | 3.2 | 9.0 | 9.2 | 4.7 |
①操作Ⅰ用到的玻璃仪器主要有___________、_____________、___________;
②加盐酸调整pH为2~3的目的为____________________________________________;
③操作Ⅱ的过程为_______________、_______________、____________、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通乙烷和氧气,其电极反应式为:C2H6+18OH--14e- =2CO32-+12H2O,7H2O+![]() O2+14e- =14OH-,有关此电池的推断正确的是
O2+14e- =14OH-,有关此电池的推断正确的是
A. 电解质溶液中电子向正极移动
B. 放电一段时间后,KOH的物质的量浓度不变
C. 通乙烷的电极为负极
D. 参加反应的O2和C2H6的物质的量之比为2:7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com