
| A | B | C | D | |
| 改变的条件 | 压强 | 温度 | 平衡体系增加H2 | 催化剂 |
| 变化的示意图 |  | 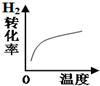 |  |  |
| A. | A | B. | B | C. | C | D. | D |
分析 根据CO(g)+2H2(g)?CH3OH(g)△H<0可知,该反应的正反应为气体体积减小的放热反应,所以
A.增大压强,平衡向正反应方向移动,甲醇的体积分数增大;
B.升高温度,平衡向逆反应方向移动,氢气的转化率下降;
C.平衡体系中增加氢气,使平衡向正反应方向移动,所以增加氢气后正反应速率大于逆反应速率;
D.使用催化剂对平衡移动没有影响,所以平衡不移动.
解答 解:根据CO(g)+2H2(g)?CH3OH(g)△H<0可知,该反应的正反应为气体体积减小的放热反应,所以
A.增大压强,平衡向正反应方向移动,甲醇的体积分数增大,而根据图结合到达平衡的时间可知,P1>P2,所以P1时的甲醇的体积分数大于P2时,故A正确;
B.升高温度,平衡向逆反应方向移动,氢气的转化率下降,与图象不符,故B错误;
C.平衡体系中增加氢气,使平衡向正反应方向移动,增加氢气的瞬间逆反应速率不变,然后逆反应速率增大,到达新平衡前正反应速率大于逆反应速率,故C错误;
D.使用催化剂对平衡移动没有影响,所以平衡不移动,达到平衡时气体的总压强相同,故D错误;
故选A.
点评 本题考查化学平衡影响因素的分析判断,化学平衡移动原理的灵活运用,和仔细观察图是解题的关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
 某研究人员应用如图所表示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.请完成下列问题:
某研究人员应用如图所表示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.请完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| 选项 | 操作 | 现象 | 结论 |
| A | ①将湿润的红色石蕊试纸靠近试管口 | 试纸不变色 | NH4Cl受热不分解 |
| B | ②将铜丝向下移动使其与浓硝酸接触 | 产生红棕色气体,用排水法收集气体 | 可以用该装置制备NO2 |
| C | ③光照 | 试管颜色变浅,出现油状滴液,少量白雾 | 甲烷与氯水发生取代反应 |
| D | 打开分液漏斗 | 右侧试管中出现白色沉淀 | 酸性:HNO3>H2CO3>H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | |||
| Y | Z |
| A. | X和Y都是非金属元素,其中X最高化合价为+5 | |
| B. | X、W的最高价氧化物在一定条件下能反应 | |
| C. | 元素X、W和氧元素可形成化学式为W2XO3,离子化合物 | |
| D. | Y、Z的氢化物的稳定性Y<2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
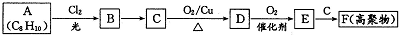
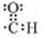 ;E一→F反应类型为缩聚反应.
;E一→F反应类型为缩聚反应. .
.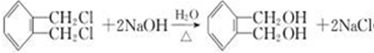 .
.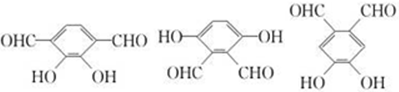 (2种即可).
(2种即可).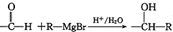 现发生反应D+G$\stackrel{H+/H_{2}O}{→}$H$→_{△}^{浓H_{2}SO_{4}}$J(
现发生反应D+G$\stackrel{H+/H_{2}O}{→}$H$→_{△}^{浓H_{2}SO_{4}}$J( ),则
),则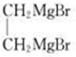 ,
,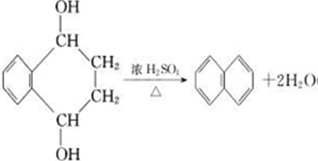 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
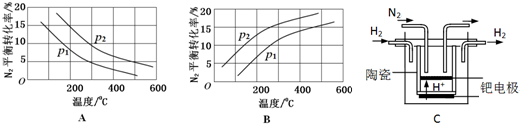
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生物炼铜比高温炼铜更清洁、成本更低 | |
| B. | 光分解水制氢气、植物秸秆制沼气、高粱制乙醇都涉及到生物质能的利用 | |
| C. | 用福尔马林灭活埃博拉病毒是利用了蛋白质变性原理 | |
| D. | 扫描隧道显微技术、超分辨率荧光显微技术等技术的发展促进了人类对物质微观结构的探索,使科学研究迈入更高水平层次 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com