铝是第二金属,是地壳中含量最多的金属,用途广泛.
(1)将某铝土精矿R(Al
2O
3、Fe
2O
3)粉末48.8g加入含1mol NaOH的溶液中,发生的反应为:Al
2O
3(s)+2NaOH(aq)+2H
2O(l)→2NaAl(OH)
4(aq)充分反应后,过滤、洗涤、干燥,得到8.0g固体,则该精矿Al
2O
3的质量分数为
(精确到0.001).往滤液中通入CO
2,发生的反应为:2NaAl(OH)
4+CO
2→2Al(OH)
3↓+Na
2CO
3+H
2O若生成0.5mol Na
2CO
3,则生成Al(OH)
3
mol.
(2)有反应Al
2O
3(s)+Na
2CO
3(s)
2NaAlO
2(s)+CO
2(g);2NaAlO
2(aq)+CO
2(g)+3H
2O→2Al(OH)
3↓+Na
2CO
3;若以铝土精矿R和Na
2CO
3为原料,除得到Al
2O
3外,还得到“赤泥”,其成分为(金属元素均以氧化物形式表示):
| Al2O3 | Fe2O3 | Na2O |
| 质量分数 | 0.065 | 0.850 | 0.029 |
每1t铝土精矿生产时:得到的赤泥
t(精确到0.001,下同);可制得Al
2O
3得
t;需要补充购买Na
2CO
3
kg.
(3)取a g Al
2O
3加入溶质的质量分数为b的硫酸溶液中,充分反应后再往溶液加入一定量的(NH
4)
2SO
4,加热、搅拌,冷却后全部溶液正好转化为45.3g铝铵矾晶体[NH
4Al(SO
4)
2?12H
2O,式量:453],则a=
;求b的值(精确到0.001):
.



 在下面的装置中,A是Cl2发生装置,C、D为气体净化装置,C中装有饱和NaCl溶液,D中装有浓H2SO4;E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.
在下面的装置中,A是Cl2发生装置,C、D为气体净化装置,C中装有饱和NaCl溶液,D中装有浓H2SO4;E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.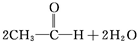
 )可与下列4种物质发生反应:①HBr ②酸性高锰酸钾溶液③氢氧化钠的水溶液 ④氢氧化钠的乙醇溶液.下列有关这些反应的说法中正确的是( )
)可与下列4种物质发生反应:①HBr ②酸性高锰酸钾溶液③氢氧化钠的水溶液 ④氢氧化钠的乙醇溶液.下列有关这些反应的说法中正确的是( )