

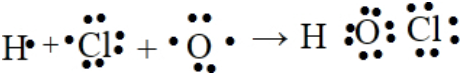 .
.  孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:解答题
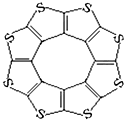 最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如图所示),每个平面上下两侧最多可储存10个H2分子.
最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如图所示),每个平面上下两侧最多可储存10个H2分子.| C-S | C=S | C16S8中碳硫键 | |
| 键长/pm | 181 | 155 | 176 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH=CH2 | B. | CH2=CHCH=CH2 | C. | CH3=CHCH3 | D. | CH3-C≡CH2-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将聚氯乙烯等塑料垃圾焚烧 | |
| B. | 推广矿物燃料脱硫技术以减少SO2等有害气体的排放 | |
| C. | 大力开采石油、煤、页岩气(主要成分为CH4)等化石燃料 | |
| D. | 电池使用后随意丢弃,无需处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将40 g NaOH固体溶解于1 L水中 | |
| B. | 将22.4 L氯化氢气体溶于水配成l L溶液 | |
| C. | 将l L 10 mol/L的浓盐酸与9 L水混合 | |
| D. | 20 g NaOH固体溶解在水中配成500 mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见氧化物,气体E是单质F所含元素的氢化物.
将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见氧化物,气体E是单质F所含元素的氢化物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com