
 钛(Ti)被称为继铁、铝之后的第三金属.
钛(Ti)被称为继铁、铝之后的第三金属.分析 (1)金属性越强,元素第一电离能越小;Ti的M层电子排布式为3s23p63d2,第四周期中原子的M层电子数比钛原子的M层电子数多8个的过渡元素,外围电子排布为3d104s1、3d104s2;
(2)根据均摊法计算晶胞中Ba、Ti、O原子数目,进而确定化合物化学式;
(3)在800℃和稀有气体氦气的保护下,用金属镁与四氯化钛反应可制取金属钛,属于置换反应,同时生成MgCl2;
四氯化钛的熔沸点比较低,易溶于有机溶剂,应属于分子晶体;
(4)Fe为26号元素,Fe原子好玩的排布式为1s22s22p63s23p63d64s2,失去4s能级2个电子、3d能级1个电子形成Fe3+.
解答 解:(1)第四周期中K的金属性最强,故K元素第一电离能最小;Ti的M层电子排布式为3s23p63d2,第四周期中原子的M层电子数比钛原子的M层电子数多8个的过渡元素,外围电子排布为3d104s1、3d104s2,分别为Cu、Zn,
故答案为:K;Cu、Zn;
(2)Ba原子处于晶胞顶点,Ba数目为8×$\frac{1}{8}$=1,Ti原子处于体心,Ti数目为1,O原子处于面心,氧原子数目为6×$\frac{1}{2}$=3,故该化合物化学式为BaTiO3,
故答案为:BaTiO3;
(3)在800℃和稀有气体氦气的保护下,用金属镁与四氯化钛反应可制取金属钛,属于置换反应,同时生成MgCl2,反应方程式为:TiCl4+2Mg$\frac{\underline{\;800℃\;}}{氦气}$2MgCl2+Ti,四氯化钛的熔沸点比较低,易溶于有机溶剂,应属于分子晶体,
故答案为:TiCl4+2Mg$\frac{\underline{\;800℃\;}}{氦气}$2MgCl2+Ti;分子;
(4)Fe为26号元素,Fe原子好玩的排布式为1s22s22p63s23p63d64s2,失去4s能级2个电子、3d能级1个电子形成Fe3+,Fe3+的核外电子排布式为1s22s22p63s23p63d5,
故答案为:1s22s22p63s23p63d5.
点评 本题考查核外电子排布、电离能、晶胞计算、晶体类型与性质,难度不大,注意原子形成离子时,并不是按构造原理中能级最高的先失去电子,而是先根据能量高的能层、再根据同一能层中能量高的能级低失去.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
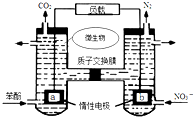
| A. | a电极发生还原反应 | |
| B. | H+由右室通过质子交换膜进入左室 | |
| C. | b电极反应式为:2NO3-+10e-+12H+═N2↑+6H2O | |
| D. | 电池工作时,电流由a电极沿导线流向b电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
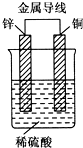 锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下:
锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下:
| A. | ①②③ | B. | ③④⑤ | C. | ①⑤⑥ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
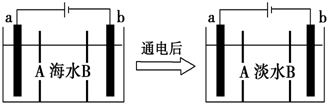
| A. | A膜是阳离子交换膜(只允许阳离子通过) | |
| B. | 通电后,海水中阴离子往b电极处运动 | |
| C. | 通电后,a电极的电极反应为4OH-4e-═O2↑+2H2O | |
| D. | 通电后,b电极上产生无色气体,溶液中出现少量白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液显碱性:CO32-+H2O?HCO3-+OH- | |
| B. | 0.1 mol•L-1氨水的pH为11:NH3•H2O?NH4++OH- | |
| C. | “84消毒液”和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体:ClO${\;}_{3}^{-}$+5Cl-+6H+=3Cl2↑+3H2O | |
| D. | 一定条件下,0.1 mol N2和0.3 mol H2充分反应放出热量小于9.2 kJ:N2(g)+3H2(g)?2NH3(g)△H=-92 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作步骤 | 预期现象与结论 |
| 步骤1:观察样品 | 溶液呈蓝绿色,①不能(填“能”或“不能”)确定产物中铁元素的价态 |
| 步骤2: 取少量溶液,滴加酸性KMnO4溶液 | ②若KMnO4溶液的紫红色褪去或变浅,说明产物中含+2价铁元素,若KMnO4溶液不褪色或红色不变浅,说明产物中不含+2价铁元素 |
| 步骤3:③另取少量溶液,滴加KSCN溶液 | 若溶液变为红色,说明产物中含+3价的铁元素;若溶液颜色无明显变化,则说明产物中不含+3价的铁元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
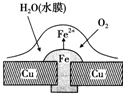
| A. | 正极的电极反应为:2H++2e-═H2↑ | |
| B. | 此过程中还涉及反应:4Fe(OH)2+2H2O+O2═4Fe(OH)3 | |
| C. | 此过程中铜并不被腐蚀 | |
| D. | 此过程中电子从Fe移向Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com