
在298 K、100 kPa时,已知:2H2O(g)===O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)===2HCl(g) ΔH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是( )
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
 已知:CH2=CH—CH=CH2+CH2=CH → ,物质A在体内脱氢酶的作用下会氧化为有害物质GHB。下图是关于物质A的一种制备方法及由A引发的一系列反应。
已知:CH2=CH—CH=CH2+CH2=CH → ,物质A在体内脱氢酶的作用下会氧化为有害物质GHB。下图是关于物质A的一种制备方法及由A引发的一系列反应。
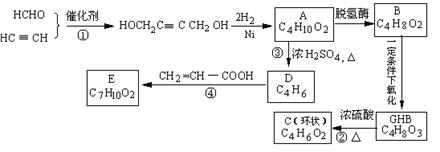
请回答下列问题:
⑴写出反应类型: 反应① 反应③ 。
⑵写出化合物B的结构简式 。
⑶写出反应②的化学方程式 。
⑷写出反应④的化学方程式 。
⑸反应④中除生成E外,还可能存在一种副产物(含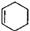 结构),它的结构简式为 。
结构),它的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中评价合理的是
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | 铁与稀盐酸反应: 2Fe+6H+=2Fe3++3H2↑ | 正确 |
| B | 大理石溶于醋酸的反应: CaCO3+ 2H+=Ca2++CO2↑+H2O | 错误,醋酸应写为分子形式CH3COOH,CaCO3应写成离子形式 |
| C | FeCl3溶液“腐蚀”铜箔: Fe3++Cu=Fe2++Cu2+ | 正确 |
| D | NH4HCO3溶液与过量NaOH浓溶液共热: NH4++ OH- | 错误,HCO3-也可以与OH-反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知299 K时,合成氨反应N2(g)+3H2(g)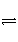
 2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)( )
2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)( )
A.一定大于92.0 kJ B.一定等于92.0 kJ
C.一定小于92.0 kJ D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式或离子方程式中,正确的是( )
A.甲烷的标准燃烧热为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) 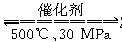 2NH3(g)
2NH3(g)
ΔH=-38.6 kJ·mol-1
C.氯化镁溶液与氨水反应:Mg2++2OH-===Mg(OH)2↓
D.氧化铝溶于NaOH溶液:Al2O3+2OH-===2AlO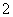 +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物的数据),根据下图回答下列问题:
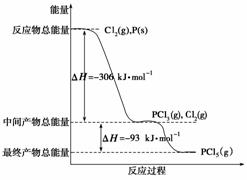
(1)PCl5分解生成PCl3和Cl2的热化学方程式____________________;上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.8 mol PCl5,反应达到平衡时还剩余0.6 mol PCl5,其分解率α1等于________;若反应温度由T1升高到T2,平衡时PCl5的分解率α2,α2________α1(填“大于”、“小于”或“等于”)。
(2)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是_________________________________________________。
(3)P和Cl2分两步反应生成1 mol PCl5的ΔH3=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是( )
 A.钠与W可能形成Na2W2化合物
A.钠与W可能形成Na2W2化合物
B.由Z与Y组成的物质在熔融时能导电
C.W得电子能力比Q强
D.X有多种同素异形体,而Y不存在同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
工业废气中氮氧化物是主要污染物,为了治理污染,常通入NH3,发生反应NOx+NH3―→N2+H2O来治理污染.现有NO、NO2的混合气体3 L,用同温同压下3.5 LNH3使其恰好完全转化为N2,则混合气体中NO、NO2的物质的量之比为
A.1∶1 B.1∶3 C.2∶1 D.1∶4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com