
| A. | 使干燥的蓝色石蕊试纸变红 | B. | 具有漂白性 | ||
| C. | 使含碱的红色酚酞试液褪色 | D. | 能与锌反应放出氢气 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

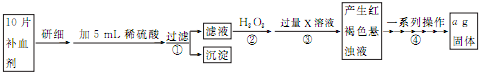

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 第三周期元素的离子半径从左到右依次减小 | |
| B. | HCl、PCl5、N2、CO2分子中所有原子都满足最外层8电子的结构 | |
| C. | 晶体内可以不存在化学键,也可以同时存在离子键和共价键 | |
| D. | 若某离子化合物X2Y3中X3+和Y2-的电子层结构相同,则X、Y两元素的原子序数之差可能是5、15或29 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | A | B | C | D |
| n(CO2)(mo1) | 1 | 2 | 3 | 4 |
| n(沉淀)(mo1) | 1 | 1 | 2 | 2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据右图回答下列问题:
根据右图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol•L-1 | B. | 1.6mol•L-1 | C. | 0.8mol•L-1 | D. | 0.4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | C、D的物质的量的比值 | D. | 气体的总物质的量 | ||
| E. | 气体的平均摩尔质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com