
| A. | 水泥 | B. | 水玻璃 | C. | 氨水 | D. | 液氯 |
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:选择题
| A. | 周期表是按各元素的相对原子质量递增的顺序从左到右排列的 | |
| B. | 同族元素的最外层电子数一定相同 | |
| C. | 同周期元素的电子层数相同 | |
| D. | 每一周期的元素都是从碱金属开始,以稀有气体元素结束 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
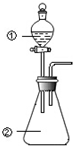 用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是 ( )
用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是 ( )| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 稀硫酸 | 硝酸亚铁溶液 | 无明显现象 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 立即产生大量白色沉淀 |
| D | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
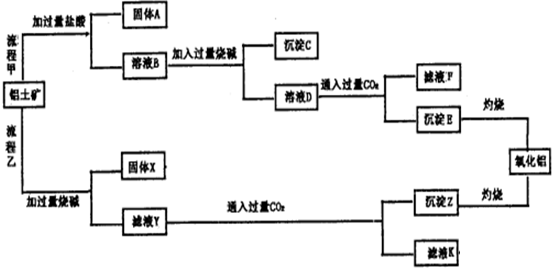
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅是酸性氧化物,不与任何酸反应 | |
| B. | 因为CO2通入水玻璃中可制得硅酸,说明碳酸的酸性比硅酸酸性强 | |
| C. | SiO2是制造光导纤维的材料,SiO2晶体中,每个硅原子与两个氧原子相连 | |
| D. | 工业上制玻璃的主要原料有:黏土、石灰石、石英 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
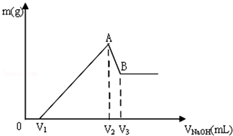 将Mg、Al组成的混合物共0.1mol溶于100mL 3mol/LHCl溶液中,再滴加1mol/LNaOH 溶液,在滴加NaOH溶液的过程中,沉淀的质量m随NaOH溶液体积V的变化如图所示:
将Mg、Al组成的混合物共0.1mol溶于100mL 3mol/LHCl溶液中,再滴加1mol/LNaOH 溶液,在滴加NaOH溶液的过程中,沉淀的质量m随NaOH溶液体积V的变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②④ | C. | ②⑤ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
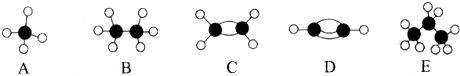
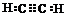 ,A的二氯取代物有1种.
,A的二氯取代物有1种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com