
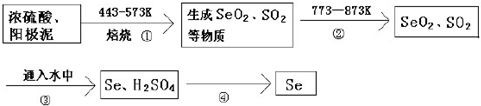
分析 在电解铜的阳极泥中含有 3-14% Se元素,由提纯流程可知,焙烧时S、Se反应转化为SO2、SeO2,二者性质相似,均为分子晶体,加热至773K时为气态,流程②的目的是使SO2、SeO2挥发出来,再加水发生SeO2+2SO2+2H2O═Se+2SO42-+4H+,Se不溶于水,则流程④为过滤操作,过滤可得到Se,
(1)浓硫酸溶解Cu2Se生成CuSO4、SO2、SeO2的结合原子守恒配平书写化学方程式;
(2)流程②的目的是使SO2、SeO2挥发出来;
(3)再加水发生SeO2+2SO2+2H2O═Se+2SO42-+4H+,Se不溶于水,氧化剂的氧化性大于氧化产物分析判断氧化剂的氧化性;
(4)参与反应过程,最后又生成的物质可以循环利用;
(5)由电子守恒可知,Mn的得电子数=Se的失电子数+Fe的失电子数,然后结合Se原子守恒计算Se的质量分数;高锰酸钾可氧化氯离子,干扰Se的含量测定.
解答 解:在电解铜的阳极泥中含有 3-14% Se元素,由提纯流程可知,焙烧时S、Se反应转化为SO2、SeO2,二者性质相似,均为分子晶体,加热至773K时为气态,流程②的目的是使SO2、SeO2挥发出来,再加水发生SeO2+2SO2+2H2O═Se+2SO42-+4H+,Se不溶于水,则流程④为过滤操作,过滤可得到Se,
(1)浓硫酸溶解Cu2Se生成CuSO4、SO2、SeO2的化学方程式为Cu2Se+6H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+SeO2+4SO2↑+6H2O,
故答案为:Cu2Se+6H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+SeO2+4SO2↑+6H2O;
(2)由上述分析可知,流程②的目的是除去难熔杂质使SO2、SeO2挥发出来,
故答案为:除去难熔杂质使SO2、SeO2挥发出来;
(3)SeO2与SO2的反应是氧化还原反应生成硫酸和Se,电荷守恒和原子守恒配平书写离子反应方程式为SeO2+2SO2+2H2O═Se+2SO42-+4H+,由Se+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$SeO2↑+2SO2↑+2H2O、H2SeO3+2SO2+H2O═Se+2SO42-+4H+可知,氧化剂的氧化性大于氧化产物的氧化性,则氧化性为H2SO4(浓)>SeO2>SO2,
故答案为:SeO2+2SO2+2H2O═Se+2SO42-+4H+;H2SO4(浓)>SeO2>SO2;
(4)由反应可知,硫酸在①中消耗,在③中生成,则硫酸可循环利用,
故答案为:硫酸;
(5)由电子守恒、原子守恒可知,Se%=$\frac{\frac{0.025L×0.01mol/L×5-0.015L×0.05mol/L}{2}×79g/mol×10}{5.0g}$×100%=3.95%,若FeCl2溶液为 Fe2+标准溶液滴至终点,对测定Se 的质量分数结果是否有影响,因为Cl-有还原性在酸性条件下与KMnO4标准溶液反应,使测得Se 的质量分数偏低,
故答案为:3.95%;Cl-有还原性在酸性条件下与KMnO4标准溶液反应,使测得Se 的质量分数偏低.
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握流程及发生的反应、混合物分离方法等为解答的关键,侧重分析、计算能力的考查,(5)为解答的难点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 46g乙醇中存在的共价键总数为7NA | |
| B. | 1 mol-OH和1 molOH-所含电子数均为9NA | |
| C. | 密闭容器中1molNO与1molO2充分反应,产物的原子数为4NA | |
| D. | 标准状况下,22.4L庚烷完全燃烧生成二氧化碳分子数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
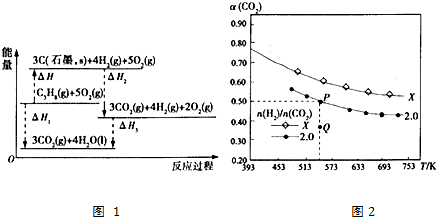
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用2Al+2NaOH+2H2O=2NaAlO2+3H2反应,设计一个原电池.
利用2Al+2NaOH+2H2O=2NaAlO2+3H2反应,设计一个原电池.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1-戊烯和2-甲基-1-丙烯 | B. | 甲醛和甲酸甲酯 | ||
| C. | 1-丁醇和甲乙醚 | D. | 丁酸和乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
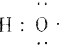 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同

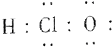
| A. | (1)(2)(4)(6) | B. | (2)(3)(5) | C. | (1)(4)(5) | D. | (1)(2)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 将0.1mol•L-1 Na2CO3溶液滴入BaCl2溶液至不再有沉淀产生,再滴加0.1mol•L-1 Na2SO4溶液,无明显现象 | 证明Ksp(BaSO4)> Ksp(BaCO3) |
| B | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液,前者溶液变蓝色,后者有黄色沉淀 | 证明KI3溶液中存在I3-?I2+I-平衡 |
| C | 向NaAlO2溶液中持续通入气体Y,先出现白色沉淀,最终沉淀又溶解 | Y可能是CO2气体 |
| D | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 证明氧化性:H2O2比Fe3+强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 金刚石 | B. | 氯化钠 | C. | 氢氧化钠 | D. | 碘 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com