
(16分)钛合金是航天航空工业的重要原料。由钛铁矿(主要成分是TiO2和Fe的氧化物)
制备Ti和绿矾(FeSO4·7H2O)等产品的一种工艺流程示意如下

已知:①TiO2+易水解,只能存在于强酸性溶液中 ②TiCl4的熔点-25℃,沸点136.4℃;SiCl4的熔点-68.8℃,沸点57.6℃ 回答下列问题:
(1)TiCl4的晶体类型是 晶体。
(2)TiO2的天然晶体中,最稳定的一种晶体结构如图,其中黑球表示 原子。

(3)钛铁矿酸浸时,主要成分TiO2反应的离子方程式为 。
(4)操作Ⅱ包含的具体操作方法有 。
(5)废液中溶质的主要成分是 (填化学式)。
(6)沸腾氧化炉中发生反应的化学方程式为 ,
制得的TiCl4液体中常含有少量SiCl4杂质,可采用 方法除去。
(7)若经事先处理后的钛铁矿只含有TiO2和Fe3O4两种氧化物,现有312kg经处理后的钛铁矿,经上述流程后(省去操作Ⅰ)制得了48kg纯净的金属钛。已知在上述流程的强酸性溶液中加过量铁粉时测得转移的电子的物质的量为2a×103mol,则理论上可制得 kgFeSO4·7H2O(假设上述各步反应均完全且各步没有损耗)。
(16分)(每空2分)(1)分子
(2)Ti或者钛
(3)TiO2+2H+=TiO2++H2O
(4)蒸发浓缩,冷却结晶,过滤(洗涤)
(5)Na2SO4.
(6)TiO2+2C+2Cl2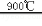 TiCl4+2CO 蒸馏或分馏
TiCl4+2CO 蒸馏或分馏
(7)278( a+3 )
【解析】
试题分析:(1)分子晶体的熔沸点较低,根据TiCl4的熔沸点的数值可以判断,TiCl4属于分子晶体;
(2)根据晶胞结构图,黑球的个数是8×1/8+1=2,白球个数是4×1/2+2=4,黑球:白球=1:2,根据晶体的化学式,Ti与O原子的个数比是1:2,所以黑球表示Ti原子;
(3)根据流程图,TiO2与硫酸反应后,生成TiO2+,所以钛铁矿酸浸时,主要成分TiO2反应的离子方程式为TiO2+2H+=TiO2++H2O;
(4)从滤液中得到晶体的操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥等,所以操作Ⅱ包含的具体操作方法有蒸发浓缩,冷却结晶,过滤(洗涤);
(5)TiSO4溶液中加入碳酸钠固体,发生双水解反应,生成TiO2晶体和二氧化碳气体,所以废液的主要成分是Na2SO4;
(6)根据流程图可知,TiO2与氯气、焦炭,在高温下发生反应生成氯化钛、CO气体,化学方程式为TiO2+2C+2Cl2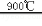 TiCl4+2CO;TiCl4液体中常含有少量SiCl4杂质,二者是互溶的液体,且SiCl4杂质的沸点较低,所以采用蒸馏的方法可除去SiCl4杂质;
TiCl4+2CO;TiCl4液体中常含有少量SiCl4杂质,二者是互溶的液体,且SiCl4杂质的沸点较低,所以采用蒸馏的方法可除去SiCl4杂质;
(7)48kgTi的物质的量是48kg/48g/mol=1kmol,则二氧化钛的质量是312kg-1kmol×80g/mol=232kg,则四氧化三铁的物质的量是232kg/232g/mol=1kmol,Fe元素的物质的量是3kmol;在强酸性溶液中加过量铁粉时测得转移的电子的物质的量为2a×103mol,该过程中Fe单质全部转化为亚铁离子,说明参加反应的Fe物质的量为a×103mol,根据元素守恒,则亚铁离子的物质的量是3kmol+a×103mol=(a+3)kmol,FeSO4·7H2O的质量是278g/mol×(a+3)kmol=278( a+3 )kg。
考点:考查物质的制备,对流程的分析,晶胞计算,基本操作的判断,氧化还原反应的计算


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源:2014-2015黑龙江省绥化市三校高一上学期期末联考化学试卷(解析版) 题型:选择题
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是

A.Mg2+、Al3+、Fe2+
B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+
D.只有Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三1月份阶段测试化学试卷(解析版) 题型:选择题
2013年6月20日,中国首次太空授课活动成功举行,神舟十号航天员王亚平在天宫一号展示了失重环境下的物理现象。若在天宫一号中进行以下实验,其中最难完成的是
A.将金粉和铜粉混合 B.将牛奶加入水中混合
C.蒸发食盐水制取食盐晶体 D.用漏斗、滤纸过滤除去水中的泥沙
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津南开区高三上学期第三次月考理综化学试卷(解析版) 题型:选择题
下列说法错误的是
A.K2FeO4能与水作用生成Fe(OH)3胶体和O2,可用于净化自来水并杀菌消毒
B.分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
C.若要除去CO2中含有的少量SO2气体,可通过盛有饱和NaHCO3溶液的洗气瓶
D.对“地沟油’’蒸馏可以获得汽油
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省攀枝花市高三上学期第二次统考理综化学试卷(解析版) 题型:选择题
已知:① C(s)+O2(g)=CO2(g) △H1; ② CO2(g)+C(s)=2CO(g) △H2;
③ 2CO(g)+O2(g)=2CO2(g) △H3; ④ 4Fe(s)+3O2(g)=2Fe2O3(s) △H4;
⑤3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列判断正确的是
A.上述反应中△H1~ H5均大于0 B.△H1=△H2- △H3
C.3△H3=△H4 + 2 △H5 D.△H5=3△H1+△H4
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省达州市普高高三上学期第一次诊断理综化学试卷(解析版) 题型:选择题
下述实验能达到预期目的的是
编号 | 实验内容 | 实验目的 |
A | 准确称取氯化钾固体,放入到100mL的容量瓶中,加水溶解,振荡摇匀,定容 | 配制100mL一定浓度的氯化钾溶液 |
B | 下层液体从分液漏斗下端口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 | 取出分液漏斗中所需的上层液体 |
C | 向盛有沸水的烧杯中滴加FeCl3饱和溶液继续加热至溶液呈红褐色 | 制备Fe(OH)3胶体 |
D | 分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其中1支试管加入少量MnO2 | 研究催化剂对H2O2分解速率的影响 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闸北区高三上学期期末化学试卷(解析版) 题型:填空题
(本题共14分)碘海醇为非离子型造影剂,尤适用于有造影剂反应的高危因素的病人。
下面是以化合物A为原料合成碘海醇的路线:

其中R-为-CH2CH(OH)CH2OH
请回答以下问题:
48.碘海醇的分子式为________。
49.A是苯的同系物,其蒸气相对氢气的密度是53,则A的结构简式是 。
50.写出A的侧链与氯气发生一氯取代的条件_____________。
51.反应①→⑤中,属于取代反应的是_____________(填序号)。
52.写出能同时满足下列条件的D的两种同分异构体的结构简式:________。
Ⅰ.苯环上有3个取代基,苯环上的一卤代物有2种;
Ⅱ.能发生银镜反应,水解产物之一能与FeCl3溶液发生显色反应;
Ⅲ.含有1个α-氨基酸的结构(例如: 属于α-氨基酸);
属于α-氨基酸);
53.已知:①
②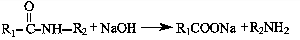
③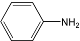 呈弱碱性,易被氧化
呈弱碱性,易被氧化
请写出以 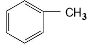 和(CH3CO)2O为原料制备染料中间体
和(CH3CO)2O为原料制备染料中间体 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
(合成路线常用的表示方式为: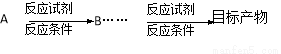 )
)
__________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闸北区高三上学期期末化学试卷(解析版) 题型:选择题
将40℃的饱和硫酸铜溶液升温至50℃,或者温度仍保持在40℃而加入少量无水硫酸铜,在这两种情况下均保持不变的是
A.硫酸铜的溶解度 B.溶液的质量
C.溶液中溶质的质量分数 D.溶液中Cu 的数目
的数目
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市嘉定区高三一模化学试卷(解析版) 题型:填空题
某芳香族化合物H(C11H12O4)是有机合成工业的一种重要的中间产物,其合成路线如下。已知2molC分子可缩合生成1mol六元环化合物分子。F常温下是气体,水溶液具有很好的防腐杀菌效果,且能与新制氢氧化铜反应。请回答下列问题:

49.F的电子式为 , A的结构简式
B转化为C的条件是
A.水解、酸化、氧化、还原 B.氧化、水解、酸化、还原
C.水解、酸化、还原、氧化 D.氧化、酸化、水解、还原
50.以C为原料可合成可降解塑料,试写出其化学方程式
51.H与氢氧化钠溶液反应的化学方程式
52.H的同分异构体有多种,请写出符合下列条件的同分异构体的结构简式
。(写两种即可)
①苯环上只有两个取代基,苯环上的一氯取代物只有两种
②1mol的H与足量的NaHCO3溶液反应,生成2molCO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com