
【题目】向NaOH和Na2CO3混合溶液中滴加0.1molL-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图 所示。下列判断正确的是

A. 在0a范围内,只发生NaOH和HCl的反应
B. ab段发生反应的离子方程式为:CO32-+2H+=CO2↑+H2O
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
【答案】C
【解析】
向氢氧化钠和碳酸钠混合溶液中滴加稀盐酸,盐酸会先与氢氧化钠反应,再与碳酸钠反应。盐酸与碳酸钠反应分为两步,首先盐酸与碳酸钠反应生成碳酸氢钠和氯化钠,然后盐酸与碳酸氢钠反应生成二氧化碳、氯化钠和水,据此解答。
反应方程式依次如下:
①HCl+NaOH=NaCl+H2O;
②HCl+Na2CO3=NaHCO3+NaCl;
③HCl+NaHCO3=NaCl+CO2↑+H2O。
A. a点以后开始生产二氧化碳气体,则0~a范围内发生的化学反应为①和②,不仅仅是酸碱中和反应,故A项错误;
B. ab段为生成二氧化碳的过程,发生反应的化学方程式为③,故其离子方程式为HCO3-+H+=CO2↑+H2O,故B项错误;
C. 由图可知生成二氧化碳0.01 mol,根据碳元素守恒,则混合物中碳酸钠的物质的量是0.01 mol,所以两步反应②、③消耗的盐酸的量均是0.01 mol,则稀盐酸的体积均是0.01mol÷0.1mol/L=0.1 L,故a=0.4-0.1=0.3,故C项正确;
D. 根据碳元素守恒可知,混合物中Na2CO3的物质的量等于生成的CO2的物质的量,为0.01 mol,因0~a(0~0.3)阶段消耗的盐酸的总的物质的量为0.3 L×0.1mol/L=0.03 mol,发生反应②碳酸钠消耗的盐酸的物质的量为0.01 mol,则反应①中氢氧化钠消耗的盐酸为0.03 mol-0.01 mol=0.02 mol,即氢氧化钠的物质的量为0.02 mol,从而可得原混合溶液中NaOH和Na2CO3的物质的量之比为2:1,故D项错误;
答案选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】化合物Ⅳ为一种重要化工中间体,其合成方法如下:

(1)化合物III的分子式为_______________
(2)写出化合物I在NaOH醇溶液中反应的化学方程式(注意:由于生成互为同分异构体的两种有机物,写出任意一种作为生成物即可)____________________________________________
(3)写出化合物Ⅱ与新制的氢氧化铜反应的化学方程式___________________________。
(4)化合物IV在浓硫酸催化下反应生成六元环状酯类化合物,写出该物质的结构简式_________。
(5)根据题给化合物转化关系及相关条件,请你推出![]() (2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物VI和VII,结构简式分别是为_______、_______,它们物质的量之比是_________。
(2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物VI和VII,结构简式分别是为_______、_______,它们物质的量之比是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学计量在化学中占有重要地位。请回答下列问题:
(1)0.3 mol NH3分子中所含原子数与约__________个H2O分子中所含原子数相等。
(2)V mL含a g Al3+的Al2(SO4)3溶液中所含SO42的物质的量浓度为_____ mol·L1。
(3)在一定温度和压强下,1体积气体X2与3体积Y2化合生成2体积气态化合物,该化合物的化学式为_________。
(4)将各0.3 mol的钠、镁、铝分别放入100 mL 1 mol·L1的盐酸中,同温同压下产生气体的体积比为_____________。
(5)锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水,当生成1 mol硝酸锌时,参加反应的硝酸的物质的量为_________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl溶液的电解产物可用于生产盐酸、漂白粉、氢氧化钠等产品。下列说法错误的是
A. HCl的电子式:![]()
B. NaOH中既含离子键又含共价键
C. 电解NaCl溶液时,阴极区pH增大的原因:2H2O +2e-=2OH-+H2↑
D. 漂白粉露置在空气中:Ca(ClO)2+CO2+H2O=CaCO3+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.2molMn02和50mL12mol/L盐酸混合后加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为(不考虑盐酸的挥发)( )
A. 等于0.3mol B. 小于0.3mol C. 大于 0.3mol,小于 0.6mol D. 等于 0.6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】六氟化硫分子(如图)呈正八面体,难以水解,在电器工业方面有着广泛用途。下列有关SF6的推测正确的是( )

A. 高温条件下,SF6微弱水解生成H2SO4和HF
B. SF6易燃烧生成二氧化硫
C. SF6中各原子均达到 8 电子稳定结构
D. 六氟化硫分子中的S—F键都是σ键,键长、键能不完全相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质与反应分类的下列说法中,正确的是 ( )
A. 碳酸钠使无色酚酞试液变红,属于碱 B. CO2溶于水能导电,属电解质
C. 硅酸钠是钠盐,也是硅酸盐 D. CO还原氧化铁获得铁,属于置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于电解质电离的下列说法中正确的是
A.电离是电解质解离为自由移动离子的过程
B.电解质溶于水时都能发生电离
C.电解质受热熔化时都能发生电离
D.电解质通电时才能发生电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学探究学习小组拟利用如图所示装置(部分固定装置已略去)测定某黑色铜硫化物样品的化学式,按照如下步骤进行了实验。
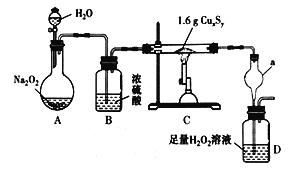
步骤一:利用右图所示装置,高温灼烧1.6gCuxSy至固体质量不再变化,得到红色固体和一种能使品红 溶液褪色的气体。
步骤二:将D中所得溶液按下述流程进行处理。
煮沸D中溶液并冷却→配制250mL溶液→取25.00mL溶液,滴入2-3滴酚酞溶液→滴定,消耗0.1 molL-1NaOH溶液20.00mL。
请回答下列问题:
(1)A装置中发生反应的化学方程式为_______________________。停止加热后还需继续通入一段时间的O2,其目的是________________________。
(2)仪器a的作用为________________。装置D中反应的化学方程式为__________________________。
(3)步骤二中配制溶液时所需的玻璃仪器除玻璃棒和烧杯外,还有___________;判断滴定终点的现象是____________________________。
(4)利用题中提供的数据可计算得出该铜硫化物的化学式为_______________。
(5)有同学认为可将装置D改为装有足量碱石灰的干燥管,通过测定反应前后干燥管的增重来计算硫元素的含量。你认为此方案(填“合理”或“不合理”),原因是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com