
| A. | 检验亚硫酸钠试样是否变质:试样$\stackrel{溶解}{→}$溶液$\stackrel{硝酸钡溶液}{→}$白色沉淀$\stackrel{稀硝酸}{→}$沉淀不溶解 | |
| B. | 除去乙酸乙酯中混有的乙酸:混合液$\stackrel{饱和碳酸钠溶液振荡}{→}$溶液分层$\stackrel{分液}{→}$得上层液体 | |
| C. | 证明酸性条件下H2O2氧化性比I2强:NaI溶液$\stackrel{30%H_{2}O_{2}溶液稀硝酸及淀粉}{→}$溶液变蓝色 | |
| D. | 鉴定盐A的成分是FeBr2: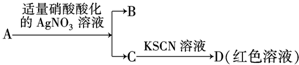 |
分析 A.硝酸能氧化亚硫酸钡生成硫酸钡沉淀;
B.乙酸能和碳酸钠反应,乙酸乙酯和碳酸钠不反应,可以用饱和碳酸钠溶液除去乙酸乙酯中的乙酸;
C.稀硝酸具有强氧化性,能氧化碘离子生成碘;
D.硝酸具有强氧化性,能氧化溴离子和亚铁离子.
解答 解:A.硝酸能氧化亚硫酸钡生成硫酸钡沉淀,从而干扰实验,应该用盐酸酸化的氯化钡溶液,故A错误;
B.乙酸能和碳酸钠反应,乙酸乙酯和碳酸钠不反应,可以用饱和碳酸钠溶液除去乙酸乙酯中的乙酸,然后采用分液方法分离,故B正确;
C.稀硝酸具有强氧化性,能氧化碘离子生成碘,干扰实验,应该用稀硫酸酸化的双氧水和淀粉试液,故C错误;
D.硝酸具有强氧化性,能氧化溴离子和亚铁离子,从而干扰实验,应该先用酸性高锰酸钾溶液检验亚铁离子,后用硝酸酸化的硝酸银溶液检验溴离子,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及离子检验、除杂、物质检验等知识点,明确物质性质及实验原理是解本题关键,侧重考查学生实验能力及评价分析能力,注意排除干扰,易错选项是D.


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
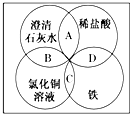 铁、稀盐酸、澄清石灰水、氯化铜溶液是初中化学中常见的物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应四个反应类型的说法正确的是( )
铁、稀盐酸、澄清石灰水、氯化铜溶液是初中化学中常见的物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应四个反应类型的说法正确的是( )| A. | 复分解反应、复分解反应、化合反应、置换反应 | |
| B. | 中和反应、置换反应、复分解反应、置换反应 | |
| C. | 复分解反应、复分解反应、置换反应、置换反应 | |
| D. | 分解反应、复分解反应、置换反应、置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,将0.5molHI气体和0.5molCl2混合后,气体的分子总数为NA | |
| B. | 标准状况下,11.2L的SO3所含分子数为0.5NA | |
| C. | 质量为7.8g的Na2S和Na2O2组成的固体混合物中含有的阴离子数总数为0.1NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
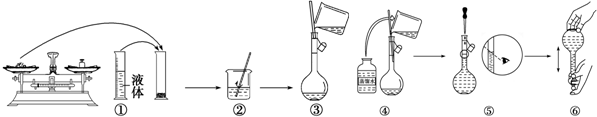
 用如图所示装置进行实验,将液体A逐滴加入到固体B中,回答下列问题:
用如图所示装置进行实验,将液体A逐滴加入到固体B中,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| C. | 工业上冶炼Al,使用Al2O3而不使用AlCl3,是因为AlCl3是共价化合物,熔融不导电 | |
| D. | 铜具有良好的导电性,常用来制作印刷电路板 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 反应时间/s | 0 | 3 | 6 | 12 | 24 |
| n(CO2)/mol | 0 | 0.6 | 0.96 | 1.5 | 1.5 |
| A. | 反应在0~3s内的平均速率v(H2O)=0.12mol•L-1•s-1 | |
| B. | 24s后,若保持其他条件不变,降低温度,达到新平衡时测得c(CO2)=0.76mol•L-1,则反应的△H<0 | |
| C. | 在T温度下,若起始时向容器中充入4.0molH2O和2.0molCO2、2.0molH2,与原平衡相比,达到平衡时,容器内压强增大 | |
| D. | 在T温度下,起始时向容器中充入2.0molH2O、1.0molCO2和1.0molH2,达到平衡时,CO2的转化率等于25% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com