
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
830℃时,向一个2 L的密闭容器中充入0.2 mol的A和0.8 mol的B,反应初始4 s内A的平均反应速率υ(A)=0.005 mol/(L·s)。下列说法正确的是
A. 4 s时c(B)为0.38 mol/L
B. 830℃达平衡时,A的转化率为20%
C. 反应达平衡后,升高温度,平衡正向移动
D. 1200℃时反应C(g)+D(g)![]() A(g)+B(g)的平衡常数为0.4
A(g)+B(g)的平衡常数为0.4
【答案】A
【解析】
A.反应初始4s内A的平均反应速率υ(A)=0.005mol/(L·s),则参加反应的A为△c(A)=0.005mol/(L·s)×4s=0.02mol/L,结合反应可以知道参加反应的B为0.02mol/L,则4 s时c(B)=0.8mol/2L-0.02mol/L=0.38mol/L,故A正确;
B.830℃达平衡时K=1.0,设转化的A为x,则
A(g) + B(g) C(g)+ D(g)
开始 0.1 0.4 0 0
转化 x x x x
平衡 0.1-x 0.4-x x x
则![]() ,计算得出x=0.08mol/L,则A的转化率为
,计算得出x=0.08mol/L,则A的转化率为![]() ,故B错误;
,故B错误;
C.由表格数据可以知道,温度越高,K越小,正反应为放热反应,则升高温度,平衡逆向移动,故C错误;
D.相同温度下,相反过程的K互为倒数,由1200℃时A(g)+B(g) C(g)+D(g)的K=0.4,则1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数为1/0.4=2.5,故D错误。答案选A。


科目:高中化学 来源: 题型:
【题目】已知19.2gCu与过量的200mL5mol/L 稀硝酸充分反应,反应方程式如下:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(1)写出该反应的离子方程式:________;
(2)标准状况下,产生NO气体的体积为:________;转移电子的物质的量为______;反应后NO3-的物质的量浓度为:______。(忽略反应前后溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
A. c1∶c2=3∶1 B. 平衡时,Y和Z的生成速率之比为2∶3
C. X、Y的转化率不相等 D. c1的取值范围为0<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一元弱酸(用HA表示)在水中的电离方程式是HA![]() H++A-,回答下列问题:
H++A-,回答下列问题:
⑴ 向纯水中加入适量HA,水的电离平衡将向________(填“正”、“逆”)反应方向移动,理由是_______。
⑵ 若向⑴所得溶液中加入适量NaCl溶液,以上平衡将向________(填“正”、“逆”)反应方向移动,溶液中c(A-)将____________(填“增大”、“减小”或“不变”),溶液中c(OH-)将____________(填“增大”、“减小”或“不变”)。
⑶ 在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH![]() )=c(Cl-),则溶液显________性(填“酸”、“碱”或“中”),a_____0.01(填“大于”、“小于”或“等于”);用含a的代数式表示NH3·H2O的电离常数Kb=_________________。
)=c(Cl-),则溶液显________性(填“酸”、“碱”或“中”),a_____0.01(填“大于”、“小于”或“等于”);用含a的代数式表示NH3·H2O的电离常数Kb=_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成都需要用它。
(1)工业上通常采用电解法制氯气,请观察图后回答下列问题:
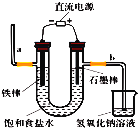
①请写出该反应的化学方程式____。
②通电后,b侧产生的气体是____![]() 填化学式
填化学式![]() 。
。
(2)某学生设计如图所示的实验装置,利用浓盐酸和二氧化锰固体制取氯气,并与潮湿的消石灰反应制取少量漂白粉![]() 这是一个放热反应
这是一个放热反应![]() ,回答下列问题:
,回答下列问题:
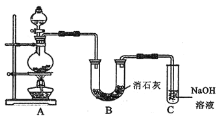
①漂白粉将在B装置的U形管中产生,其化学方程式是_____。
②装置C的作用是___。
(3)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3) 2,为避免此副反应的发生,可采取的措施是___。
②为避免另一个副反应的发生,可将装置作何改进___ 。
③家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是____。
A.食盐 B.食醋 C.烧碱 D.纯碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.在一定温度和压强下,各种气态物质体积大小由分子间距离决定
B.相同温度时,CO2和N2O若体积相同,则它们的质量一定相同
C.100g浓度为18mol/L的浓硫酸中加入等质量的水稀释浓度大于9mol/L
D.14 mol/L的H2SO4溶液的溶质质量分数为80%,那么7 mol/L的H2SO4溶液的溶质质量分数将大于40%
查看答案和解析>>
科目:高中化学 来源: 题型:
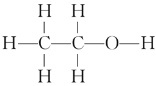
【题目】乙醇(C2H5OH)是生活中常见的物质,下图给出了乙醇的结构式和球棍模型。

I.乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。
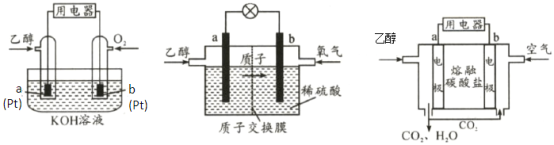
碱性乙醇燃料电池 酸性乙醇燃料电池 熔融盐乙醇燃料电池
(1)三种乙醇燃料电池中正极反应物均为_______。(填化学式)
(2)碱性乙醇燃料电池中,电极a上发生的电极反应式为_______,使用空气代替氧气,电池工作过程中碱性会不断下降,其原因是_______。
(3)酸性乙醇燃料电池中,电极b上发生的电极反应式为_______。
(4)熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,CO32-向电极_______(填“a”或“b”)移动。
II. 已知气相直接水合法可以制取乙醇:H2O(g)+C2H4(g)![]() CH3CH2OH(g)。当n(H2O):n(C2H4)=1:1时,乙烯的平衡转化率与温度、压强的关系如下图:
CH3CH2OH(g)。当n(H2O):n(C2H4)=1:1时,乙烯的平衡转化率与温度、压强的关系如下图:
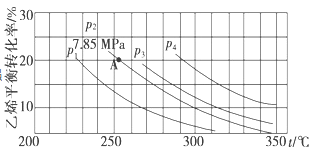
(1)图中压强p1、p2、p3、p4的大小顺序为:_______,理由是:_______。
(2)气相直接水合法采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290℃,压强6.9 MPa,n(H2O):n(C2H4)=0.6:1。该条件下乙烯的转化率为5%。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有_______、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴被誉为战略物资,有出色的性能和广泛的应用.以水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、A12O3、MnO等)制取钴产品的工艺流程如下:

已知:
①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、A13+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Mn(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
回答下列问题:
(1)写出浸出过程、Co2O3发生反应的离子方程式:_________________________。
(2)写出NaC1O3发生反应的主要离子方程式:______________________________;
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为____________________________。
(4)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________________;萃取剂使用的最佳pH范围是__________(填代号)。
A.1.0~1.5 B.2.0~2.5 C.3.0~3.5 D.4.0~4.5

(5)“沉钴”时生成CoCO3的离子方程式为__________________________________。
(6)在空气中焙烧CoCO3生成CoxOy和CO2,测得充分煅烧后固体质量为4.82g,CO2的体积为1.344L(标准状况),则CoxOy的化学式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A. 乙醇和丙三醇互为同系物
B. 环己烯(![]() )分子中的所有碳原子共面
)分子中的所有碳原子共面
C. 分子式为C5H10O2,且属于羧酸的同分异构体共有9种(不考虑立体异构)
D. 二环己烷( ![]() )的二氯代物有7种结构(不考虑立体异构)
)的二氯代物有7种结构(不考虑立体异构)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com