
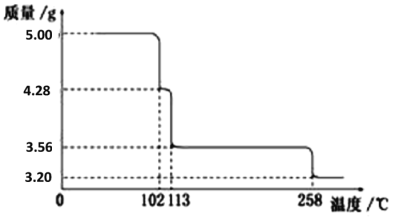
【题目】5.00g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
请回答下列问题:
(1)试确定110℃时固体物质的化学式_____________________;
(2)取200℃所得样品,加热至280oC, 该反应的化学方程式为:_______________;
(3)将280oC所得产物在570℃下灼烧得到的主要产物是1.60g黑色粉末和一种氧化性气体,黑色粉末的化学式为______________。
(4)把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体其存在的最高温度是______;
(5)天平两端各放一只质量相等的烧杯,内盛等体积等浓度的足量稀盐酸,将物质的量都为amol的铝和镁分别放入左盘和右盘的烧杯中,反应完毕后,在哪一盘的烧杯中加入多少克同种金属才能平衡 ________。
【答案】CuSO4·3H2O CuSO4·H2O![]() CuSO4+H2O CuO 102℃ 右盘 24a/11g镁
CuSO4+H2O CuO 102℃ 右盘 24a/11g镁
【解析】
由图分析可知CuSO4·5H2O受热到102℃时开始脱水分解,113℃时可得到较稳定的一种中间物,到258℃时才会继续分解,根据分解前后固体质量的变化即可确定此时固体物质的化学式,据此解答。
(1)CuSO4·5H2O受热到102℃时开始脱水分解,113℃时可得到较稳定的一种中间物,102℃时固体质量减少5.00g-4.28g=0.72g,即产生水的物质的量是0.72g÷18g/mol=0.04mol,原固体的物质的量是5.00g÷250g/mol=0.02mol,共含有0.1mol水,则此时晶体中水的物质的量是0.1mol-0.04mol=0.06mol,所以结晶水和硫酸铜的物质的量之比是0.06:0.02=3:1,则110℃时固体物质的化学式CuSO4·3H2O;
(2)113℃时固体质量减少5.00g-3.56g=1.44g,即产生水的物质的量是1.44g÷18g/mol=0.08mol,则此时晶体中水的物质的量是0.1mol-0.08mol=0.02mol,所以结晶水和硫酸铜的物质的量之比是0.02:0.02=1:1,则113℃时固体物质的化学式CuSO4·H2O;258℃时固体质量减少5.00g-3.20g=1.8g,即产生水的物质的量是1.8g÷18g/mol=0.1mol,则此时晶体中水的物质的量是0.1mol-0.1mol=0,所以258℃时固体物质的化学式CuSO4,因此取200℃所得样品,加热至280oC时反应的化学方程式为CuSO4·H2O![]() CuSO4+H2O;
CuSO4+H2O;
(3)0.02mol胆矾可以得到0.02mol氧化铜,质量是0.02mol×80g/mol=1.60g,所以温度为570℃灼烧得到的黑色粉末应是CuO,氧化性气体则为SO3;
(4)把该黑色粉末溶解于稀硫酸中生成硫酸铜和水,经浓缩、冷却,有晶体析出,得到的晶体为CuSO45H2O,根据图像可知其存在的最高温度是102℃;
(5)根据题意,物质的量分别都为a mol的铝和镁两种金属,分别发生反应
2Al+6HCl=2AlCl3+3H2↑ 增重
2mol 2×27g-3×2g=48g
amol 24ag
Mg+2HCl=MgCl2+H2↑ 增重
1mol 24g-2g=22g
amol 22ag
则右盘增重小,所以右盘的烧杯轻,设应在右盘加入xmol镁才能平衡,根据方程式可知
Mg+2HCl=MgCl2+H2↑ 增重
1mol 24g-2g=22g
(a+x)mol 22(a+x)g
因此有22(a+x)g=24ag
解得x=a/11
即应在右盘加入24a/11克镁才能平衡。


科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化:
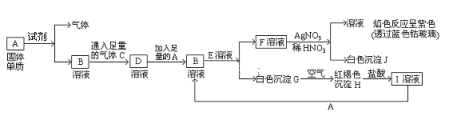
(1)A转化为B及气体这步反应中应加入的试剂是(填化学式)___________;
(2)写出B的化学式___F的化学式____;
(3)写出由G转变成H的化学方程式___________________;
(4)写出检验I溶液中阳离子的试剂_____________;向I溶液中加入A的有关离子反应方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把2.3g的CO与H2组成的混合气体与足量的O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加( )
A. 7.2g B. 3.6g C. 2.3g D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.1mol/L、体积为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg![]() 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是
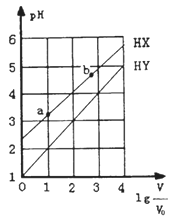
A. HX、HY都是弱酸,且HX的酸性比HY的弱
B. 相同温度下,电离常数K(HX):a>b
C. 常温下,由水电离出的c(H+)·c(OH-):a<b
D. lg![]() =3,若同时微热两种溶液,则
=3,若同时微热两种溶液,则![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M(C16H14O2)是一种香料,工业上利用烃A和甲苯为主要原料,按下列路线合成:
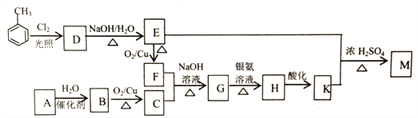
已知:①气态烃A在标准状况下的密度是1.25g/L,能作为果实催熟剂
②醛在碱性溶液中能发生羟醛缩合反应,再脱水生成不饱和醛:
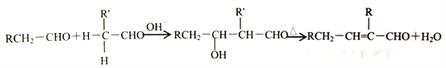
请回答下列问题:
(1)K的名称是_______;G中含有的官能团名称是_______ 。
(2)写出D→E的化学方程式_______ 。
(3)A-B的反应类型是_______;M的结构简式是_______ 。
(4)同时满足下列三个条件的K的同分异构体有_____种(不考虑立体异构)。
①遇FeCl溶液发生显色反应;
②能发生银镜反应;
③除苯环以外不再含有其他环状结构。
其中核磁共振氢谱为五组峰的结构简式为_______。
(5)以乙醇为起始原料,选用必要的无机试剂合成1-丁烯,完善以下合成路线(用结构简式表示有机物,箭头上注明试剂和反应条件)______。
CH3CH2OH![]() CH3CHO
CH3CHO![]() ……
……![]() ……
……![]() CH3CH2CH=CH2
CH3CH2CH=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把含硫酸铵和硝酸铵的混合液a L分成两等份.一份加入含b mol NaOH的溶液并加热,恰好把NH3全部赶出;另一份需消耗c mol BaCl2才能使SO42﹣完全沉淀,则原溶液中NO3﹣的物质的量浓度为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为800 ℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
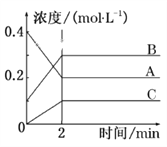
A. A是反应物
B. 前2 min A的分解速率为0.1 mol·L-1·min-1
C. 达平衡后,若升高温度,平衡向正反应方向移动
D. 反应的方程式为2A(g)![]() 2B(g)+C(g)
2B(g)+C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C三种烃,其球棍模型如下图:

(l)等质量的以上三种物质完全燃烧时,消耗O2的量最多的是______(填分子式),该烃与氧气反应的化学方程式为_________;
(2)等质量的以上三种物质燃烧时,生成二氧化碳最多的是_____(填结构简式), 生成水最多的是_______(填结构式);
(3)相同状况下,等体积的以上下种物质完全燃烧时,消耗O2的量最多的是_____(填物质名称),该烃电子式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铝、铁三种金属,分别与足量的同体积同浓度的盐酸反应,同温同压下,产生相同体积的氢气,则反应中( )
A. 金属失去电子数目相等 B. 消耗金属的质量相等
C. 消耗金属的物质的量相等 D. 消耗的HCl的量不相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com