
| A. | 纤维素水解的产物可以制乙醇 | |
| B. | 乙烯、聚乙烯、聚氯乙烯都属于烃,都可以使溴水褪色 | |
| C. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| D. | NH4NO3、KNO3、KClO3与Na2S、C2H5OH混合搭存放在同一仓库 |
分析 A.纤维素水解生成葡萄糖,葡萄糖发生酒化反应生成乙醇;
B.聚氯乙烯含Cl元素,聚乙烯、聚氯乙烯均不含双键;
C.碳纤维为碳的单质;
D.氧化剂与还原剂易发生氧化还原反应,乙醇易燃易爆.
解答 解:A.纤维素水解生成葡萄糖,葡萄糖发生酒化反应生成乙醇,则纤维素水解的产物可以制乙醇,故A正确;
B.聚氯乙烯含Cl元素,聚乙烯、聚氯乙烯均不含双键,则乙烯、聚乙烯都属于烃,三种物质中只有乙烯可以使溴水褪色,故B错误;
C.碳纤维为碳的单质,不是有机高分子,故C错误;
D.氧化剂与还原剂易发生氧化还原反应,乙醇易燃易爆,则试剂不能混合搭存放在同一仓库,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的组成、性质、有机反应等为解答的关键,侧重分析与应用能力的考查,注意化学生活的联系,题目难度不大.


科目:高中化学 来源: 题型:解答题
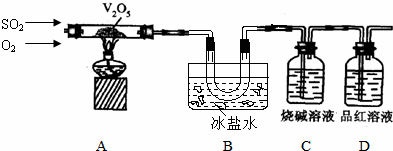
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
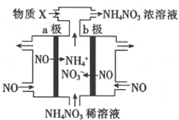 电解NO制备NH4NO3的工作原理如图所示,为使电解产物全部转化为NH4NO3,通入物质X.下列说法不正确的是( )
电解NO制备NH4NO3的工作原理如图所示,为使电解产物全部转化为NH4NO3,通入物质X.下列说法不正确的是( )| A. | a极接电源的负极 | |
| B. | 阳极反应为:NO-3e-+2H2O=NO3-+4H+ | |
| C. | 阴极反应为:NO+5e-+6H+=NH4++H2O | |
| D. | X为NH3最终制得3molNH4NO3理论上需补充2molX物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
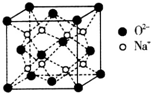 H、C、N、O、Na、Fe、Cu是常见的七种元素,请回答下列问题:
H、C、N、O、Na、Fe、Cu是常见的七种元素,请回答下列问题: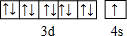 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向溶液中滴加BaCl2溶液,再加入盐酸 | 产生白色沉淀不溶解 | 原溶液中有SO42- |
| B | 将黄豆粒大的钠放入CuSO4稀溶液中 | 产生红色固体 | 金属性:Na>Cu |
| C | 向1mL20%的蔗糖溶液中加入几滴稀硫酸,水浴加热后取少量NaOH溶液,再加入新制的Cu(OH)2,加热 | 产生砖红色沉淀 | 蔗糖水解产生葡萄糖 |
| D | 向盛有少量Na2O2固体的试管中加入一定量的蒸馏水,再滴加酚酞试液 | 溶液变红后褪色 | 说明可能生成了H2O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
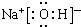 .
.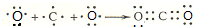
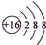 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol S(g)与1 mol O2(g) 的总能量比1 mol SO2(g)的总能量低QkJ | |
| B. | 1mol S(g) 与1 mol O2(g) 反应生成1 mol SO2(g)放出Q kJ的热量 | |
| C. | S(s)+O2(g)=SO2(g)△H<-Q kJ•mol-1 | |
| D. | 1个S(g)与1个O2(g) 完全反应可以放出Q kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 月球上的二氧化硅所含元素都是第三周期元素 | |
| B. | 3He可发生核聚变反应,这是一种化学变化 | |
| C. | 月球上的3He是一种新元素 | |
| D. | 月球和地球上的钛、铁、铬、镍等原子应该具有相同的核外电子排布 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com