
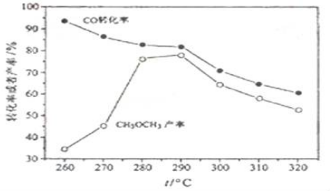
 二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,由合成气(组成为H2、CO、少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应:
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,由合成气(组成为H2、CO、少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应:分析 (1)二甲醚合成反应④对于CO转化率的影响,结合甲醇合成反应,水煤气变换反应和化学平衡移动原理分析判断;
(2)依据热化学方程式和盖斯定律计算得到,依据计算得到的反应结合化学平衡移动原理分析判断增大压强的影响;
(3)依据化学平衡特征和平衡移动原理分析;
(4)燃料电池中燃料在负极上失电子发生氧化反应,正极发生还原反应,书写电极反应.
解答 解:(1)二甲醚合成反应④对于CO转化率的影响,消耗甲醇,促进甲醇合成反应(①)CO(g)+2H2(g)═CH3OH(g)平衡右移,CO转化率增大,生成的H2O,通过水煤气变换反应(③)CO(g)+H2O(g)═CO2(g)+H2 (g)消耗部分CO,
故答案为:消耗甲醇,促进甲醇合成反应(①)平衡右移,CO转化率增大,生成的H2O,通过水煤气变换反应③消耗部分CO;
(2)①CO(g)+2H2(g)═CH3OH(g)△H1=-90.1kJ•mol-1
④2CH3OH(g)═CH3OCH3(g)+H2O(g)△H4=-24.5kJ•mol-1
依据盖斯定律①×2+④得到:2CO(g)+4H2(g)=CH3OCH3+H2O(g)△H=-204.7kJ•mol-1,
故答案为:2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)△H=-204.7kJ•mol-1;
(3)CO转化率随温度升高而降低,是因为反应是放热反应,升温平衡逆向进行,
故答案为:反应放热,温度升高,平衡左移;
(4)若电解质为碱性,氧气在正极发生还原反应,O2+2H2O+4e-=4OH-,二甲醚直接燃料电池的负极反应为二甲醚失电子生成二氧化碳,碱溶液中生成碳酸盐,结合原子守恒和电荷守恒写出电极反应为:CH3OCH3+16OH--12e-=2CO32-+11H2O,
故答案为:CH3OCH3+16OH--12e-=2CO32-+11H2O.
点评 本题考查了物质制备原理分析,热化学方程式和盖斯定律的应用,化学平衡移动原理的分析判断,电极方程式的书写,题目难度中等.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 食盐和醋可作调味剂,也可用作食品防腐剂 | |
| B. | 植物秸秆不可用来制造酒精 | |
| C. | 镁合金可用于制造火箭、导弹和飞机的部件 | |
| D. | 二氧化硅可用于制光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾易水解生成胶体,可用作净水剂 | |
| B. | 晶体硅熔点高硬度大,可用作芯片 | |
| C. | 氮气化学性质稳定,可用作粮食保护气 | |
| D. | NaClO具有强氧化性,可作织物漂白剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
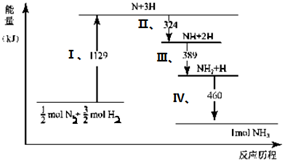
| A. | Ⅰ中1129 kJ为该反应过程的活化能 | |
| B. | N2(g)+3H2 (g)?2NH3 (g)△H=2(324+389+460-1129)kJ/mol | |
| C. | Ⅱ、Ⅲ、Ⅳ均为放热过程 | |
| D. | N2(g)+3H2 (g)?2NH3 (g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
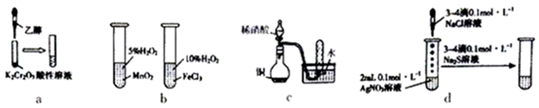
| A. | a图,滴加乙醇,试管中橙色溶液变为绿色,乙醇发生取代反应生成乙酸 | |
| B. | b图,左边试管中产生气泡迅速,说明二氧化锰的催化效果比氯化铁好 | |
| C. | c图,根据试管中收集到无色气体,能验证铜与稀硝酸的反应产物是NO | |
| D. | d图,试管中先有白色沉淀,后有黑色沉淀生成,能确定Ksp(AgCl)>Ksp(Ag2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com