
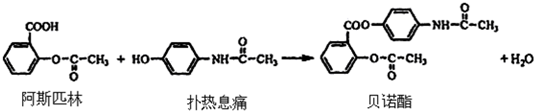
 .
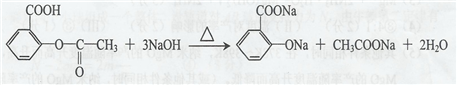
.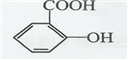 .
.分析 (1)阿斯匹林结构简式中含有的官能团为羧基、酯基、苯环;
(2)酚羟基的邻对位易发生取代,阿司匹林分子式为C8H8O4,燃烧生成二氧化碳和水,据此分析耗氧量;
(3)阿司匹林中-COOH、-COOC-及水解生成的酚-OH均与NaOH反应;
(4)发生水解反应,且有两种产物相同,为邻羟基苯甲酸和乙酸,芳香族化合物中含苯环;
(5)A.生成贝诺酯为酯化反应,酯化反应属于取代反应;
B.阿司匹林中含-COOH,而扑热息痛含酚-OH,具有苯酚的性质;
C.阿司匹林含O元素;
D.贝诺酯中不含氨基和羧基.
解答 解:(1)由阿斯匹林结构简式 可知,其含有的官能团为;-COOH、苯环、-COOC-(酯基),
可知,其含有的官能团为;-COOH、苯环、-COOC-(酯基),
故答案为:-COOH,-COO-;
(2)扑热息痛含有酚羟基,酚羟基的邻对位易发生取代,所以1mol扑热息痛最多可跟2mol溴发生取代,
由阿斯匹林结构简式可知其分子式为C8H8O4,与O2完全氧化为CO2和水,反应为C8H8O4+8O2$\stackrel{点燃}{→}$8CO2+4H2O,所以1mol阿司匹林需要耗氧8mol,
故答案为:2;8;
(3)阿司匹林中-COOH、-COOC-及水解生成的酚-OH均与NaOH反应,该反应为: ,
,
故答案为: ;
;
(4)发生水解反应,且有两种产物相同,为邻羟基苯甲酸和乙酸,芳香族化合物中含苯环,则邻羟基苯甲酸属于芳香族化合物,其结构简式为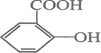 ,
,
故答案为: ;
;
(5)A.生成贝诺酯为-COOH和-OH的酯化反应,属于取代反应,故A正确;
B.阿司匹林中含-COOH,而扑热息痛含酚-OH,具有苯酚的性质,遇氯化铁发生显色反应,则FeCl3溶液可区别阿司匹林和扑热息痛,故B正确;
C.阿司匹林含O元素,不属于芳香烃,故C错误;
D.贝诺酯中不含氨基和羧基,则不属于氨基酸,故D错误;
故答案为:AB.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酯化反应及酯的水解反应的考查,注意相关概念的辨析,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ③④⑤ | B. | ②④⑥ | C. | ②③④ | D. | ①②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气可用于制漂白粉 | B. | 液氨可用作制冷剂 | ||
| C. | 活性炭可以去除冰箱中的异味 | D. | 二氧化硅可做半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,密度为d g/L的某气体纯净物一个分子的质量为$\frac{22.4}{{N}_{A}}$g | |
| B. | 常温常压下,17g甲基(-14CH3)所含的中子数为9NA | |
| C. | 25℃时,1 L pH=13的NaOH溶液中含有NA个氢氧根离子 | |
| D. | 4.6 g Na在空气中完全反应生成Na2O、Na2O2,转移0.2NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com