
【题目】下列说法正确的是( )
A. 由原子构成的晶体不一定是原子晶体 B. 分子晶体中的分子内不含有共价键
C. 分子晶体中一定有非极性共价键 D. 分子晶体中分子一定紧密堆积
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】如图装置制取溴苯,回答下列问题:
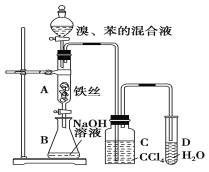
(1)写出A中反应的化学方程式:_______________________;
(2)C中盛放CCl4的作用是___________________________;
(3)D中加入硝酸银溶液,实验后溶液中能看到的实验现象为_____________________;
(4)常用于鉴别苯和甲苯的试剂为_________________;
(5)E物质分子式为C8H10,且苯环上的一氯代物只有一种,则E的名称为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C7H16、C5H11Cl、C5H10(链状,不考虑空间构型)的同分异构体的数目分别有( )种
A. 9,8,5 B. 8,9,5 C. 9,9,6 D. 8,8,6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.氯气能将单质铁还原为氯化铁
B.盐酸既有氧化性又有还原性
C.氢气在氯气中剧烈燃烧,火焰呈苍白色,有白烟生成
D.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。已知: pM=-lgc(M),pc(CO32-)=-lgc(CO32-)。下列说法正确的是
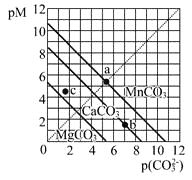
A. MgCO3、CaCO3、MnCO3的Ksp依次增大
B. a点可表示MnCO3的饱和溶液,且c(Mn2+)> c(CO32-)
C. b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-)
D. c点可表示MgCO3的不饱和溶液,且c(Mg2+)<c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】张青莲是我国著名的化学家,1991年他准确测得In的相对原子质量为114.818,被国际相对原子质量委员会采用为新的标准值。下列说法中,错误的是( )
A. ![]() In是In元素的一种核素 B.
In是In元素的一种核素 B. ![]() In原子核内有49个中子
In原子核内有49个中子
C. ![]() In原子核内质子数和中子数之和为115 D.
In原子核内质子数和中子数之和为115 D. ![]() In原子核外有49个电子
In原子核外有49个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.0ml于锥形瓶中,加入10.0ml的KI溶液(足量),发生的反应为:Cl2+2KI=2KCl+I2,滴入指示剂2~3滴。
②②取一滴定管依次用自来水、蒸馏水洗净后,再用0.01mol·L-1Na2S2O3溶液润洗,然后装入0.01mol·L-1Na2S2O3溶液到0刻度以上,排出下端尖嘴内的气泡,调整液面至0刻度或0刻度下某一位置,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+ 2Na2S4O6 试回答下列问答:
(1)步骤①加入的指示剂是_______________________________。
(2)步骤②应使用________式滴定管。
(3)判断达到滴定终点的实验现象是___________________________________;
(4)用0.1032mol/L HCl溶液滴定未知浓度的NaOH溶液,下列情况对实验结果无影响的是____________
A.酸式滴定管未用标准盐酸溶液润洗
B.锥形瓶未用待测液润洗
C.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D.滴定时将标准液溅出锥形瓶外
(5)碳酸H2CO3,K1=4.3×10-7,K2=5.6×10-11,草酸H2C2O4,K1=5.9×10-2,K2=6.4×10-50.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(选填“大于”、“小于”或“等于”)。若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____________。(选填编号)
A.c(H+)>c(HC2O4-)>c[HCO3-)>c[CO32-) B.c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
C.c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-) D.c(H2CO3) >c(HCO3-)>c(HC2O4-)>c(CO32-)
(6)已知:①难溶电解质的溶度积常数:Ksp(CaF2)=1.5×10-10 ②25℃时,2.0×10-3mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:请根据以下信息回答下列问题:
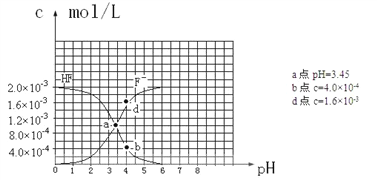
①25℃时,HF电离平衡常数的数值Ka≈_______________________________。
②4.0×10-3 mol·L-1HF溶液与4.0×10-4 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法处理酸性含铬废水(主要含有Cr2O![]() )时,以铁板作阴、阳极,处理过程中存在反应Cr2O
)时,以铁板作阴、阳极,处理过程中存在反应Cr2O![]() +6Fe2++14H+===2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。下列说法不正确的是( )
+6Fe2++14H+===2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。下列说法不正确的是( )
A. 阳极反应为Fe-2e-===Fe2+
B. 电解过程中溶液pH不会变化
C. 处理过程中有Fe(OH)3沉淀生成
D. 每转移12 mol电子,有1 mol Cr2O![]() 被还原
被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com