
| A. | K+、H+、SO42-、OH- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | Na+、H+、Cl-、HCO32- | D. | Na+、Cu2+、Cl-、SO42- |
分析 配制的溶液中含有的离子之间必须能够大量共存,
A.氢离子与氢氧根离子反应;
B.钙离子与碳酸根离子反应生成碳酸钙沉淀;
C.氢离子与碳酸氢根离子反应生成二氧化碳和水;
D.四种离子之间不反应,能够共存.
解答 解:A.H+、OH-之间反应生成水,无法大量共存于同一溶液中,故A错误;
B.Ca2+、CO32-之间反应生成难溶物碳酸钙,无法大量共存于同一溶液中,故B错误;
C.H+、HCO3-之间发生反应,无法大量共存于同一溶液中,故C错误;
D.Na+、Cu2+、Cl-、SO42-之间不反应,在同一溶液中可以大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,题目难度不大,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | NaOH、KOH、CsOH碱性依次减弱 | |
| B. | Li、Na、K、Rb、Cs单质的失电子能力逐渐增强 | |
| C. | Li、Na、K、Rb、Cs的最外层电子数依次减小 | |
| D. | Li、Na、K、Rb、Cs电子层数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
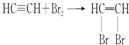
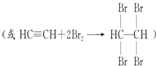
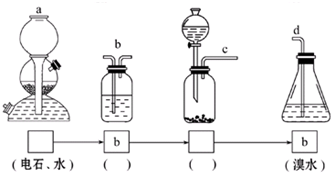
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它是第Ⅷ族元素 | |
| B. | 它是第六周期元素 | |
| C. | 它属于过渡元素 | |
| D. | 它的某种同位素核内中子数大于质子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
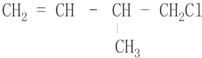
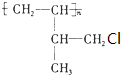 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| B. | NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| C. | 硫化钠的水解反应:S2-+H3O+HS-+H2O | |
| D. | 将0.2 mol•L-1的NH4Al(SO4)2溶液与0.3 mol•L-1的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
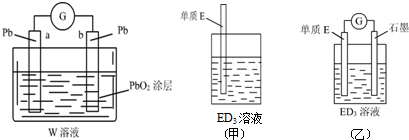
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com