
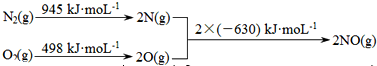
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
| c(CH3OH) |
| c(CO)c2(H2) |
| c(CH3OH) |
| c(CO)c2(H2) |
| 0.8 |
| 0.4×0.42 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 )
)| 实验序号 | 混合物 质量 | 物质的量关系n(Y)/n(Z) | 产物的量 | ||
| m(CO2)/g | m(H2O)/g | V(N2)/mL | |||
| ① | 3g | 2:3 | 3.08 | 1.8 | 672 |
| ② | 3g | 3:2 | 3.52 | 1.8 | 448 |
查看答案和解析>>
科目:高中化学 来源: 题型:
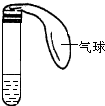 某学生课外活动小组利用如图所示装置分别做如下实验:在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是
某学生课外活动小组利用如图所示装置分别做如下实验:在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是查看答案和解析>>
科目:高中化学 来源: 题型:
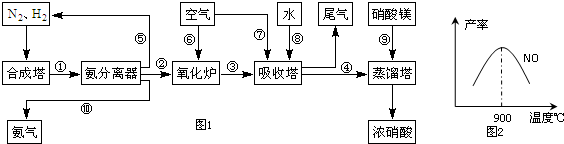
| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
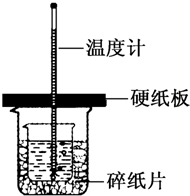 根据中和热的测定实验填空.
根据中和热的测定实验填空.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1000mL,21.2g |
| B、950mL,20.14g |
| C、任意规格,21.2g |
| D、500mL,10.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)=c(OH-)+c(A-) |
| B、pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) |
| C、物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) |
| D、0.1 mol?L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(A2-)>c(H2A) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com