
分析 该物质中含有碳碳双键和羧基,所以具有烯烃、羧酸的性质,能发生加成反应、加聚反应、取代反应、氧化反应、酯化反应,据此分析解答.
解答 解:(1)含有羧基,所以能和NaOH发生中和反应,反应方程式为CH2=CHCOOH+NaOH→CH2=CHCOONa+H2O,故答案为:CH2=CHCOOH+NaOH→CH2=CHCOONa+H2O;
(2)含有碳碳双键,所以能和溴发生加成反应,反应方程式为CH2=CHCOOH+Br2→CH2BrCHBrCOOH,故答案为:CH2=CHCOOH+Br2→CH2BrCHBrCOOH;
(3)含有羧基,所以能和乙醇在一定条件下发生酯化反应,反应方程式为CH2=CHCOOH+C2H5OH $→_{△}^{浓硫酸}$CH2=CHCOOC2H5+H2O,故答案为:CH2=CHCOOH+C2H5OH $→_{△}^{浓硫酸}$CH2=CHCOOC2H5+H2O;
(4)含有碳碳双键,所以能和氢气发生加成反应,反应方程式为CH2=CHCOOH+H2 $→_{△}^{催化剂}$CH3CH2COOH,
故答案为:CH2=CHCOOH+H2 $→_{△}^{催化剂}$CH3CH2COOH .
点评 本题考查有机物结构和性质,为高频考点,把握官能团及其性质关系即可解答,侧重考查烯烃、羧酸的性质,题目难度不大.


科目:高中化学 来源: 题型:解答题
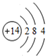
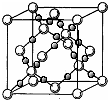 已知A、B、C、D、E五种元素的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2对成对电子.请回答下列问题:
已知A、B、C、D、E五种元素的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2对成对电子.请回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中一共有16个纵行 | |
| B. | 除零族元素外,非金属元素全都是主族元素 | |
| C. | 同周期ⅡA族与ⅢA族元素的原子序数之差可能为25 | |
| D. | 同族上下相邻两种元素的原子序数之差可能为32 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
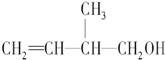
| A. | 能与金属钠反应并放出氢气 | |
| B. | 能在催化剂作用下与H2发生加成反应 | |
| C. | 能发生银镜反应 | |
| D. | 在浓H2SO4催化下能与乙酸发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 重晶石的主要成分是硫酸钡,可溶于胃酸 | |
| B. | 塑化剂和塑料都是高分子化合物 | |
| C. | 82Pb位于周期表第六周期IVA族 | |
| D. | 碘元素的相对原子质量是131 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:P<S<O<F | B. | 原子半径大小:Na>S>O | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 还原性强弱:F->Cl->I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氟的气化和液溴的气化 | B. | 干冰和氯化铵分别受热变为气体 | ||
| C. | 二氧化硅和铁分别受热熔化 | D. | 食盐和葡萄糖分别溶解在水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁跟盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 磷酸二氢钙溶液跟氢氧化钙溶液反应 H2PO4-+2OH-═PO43-+2H2O | |
| C. | 碳酸钙跟醋酸反应:CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ | |
| D. | 铜片跟稀硝酸反应 Cu+NO3-+4H+═Cu2++NO↑+2H2O |
查看答案和解析>>
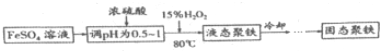
科目:高中化学 来源: 题型:解答题
| X | Y | Z | M |
| R | W |
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com