
分析 将23g金属钠投入180g水中,根据n=$\frac{m}{M}$分别计算出钠、水的物质的量;发生反应为2Na+2H2O=2NaOH+H2↑,得到溶液为氢氧化钠溶液,放出气体为氢气,依据化学方程式定量关系计算得到氢气物质的量,再根据V=nVm计算出生成氢气体积;最后根据溶液中微粒个数之比等于物质的量之比计算出反应后的溶液中钠离子与水分子的个数比.
解答 解:23g钠的物质的量是:$\frac{23g}{23g/mol}$=1.0mol,
180水的物质的量是:$\frac{180g}{18g/mol}$=10mol,
根据反应2Na+2H2O=2NaOH+H2↑可知,1.0molNa与水完全反应生成氢气的物质的量为:1.0mol×$\frac{1}{2}$=0.5mol,
则生成的氢气在标准状况下的体积为:22.4L/mol×0.5mol=11.2L;
根据质量守恒可知反应后溶液中钠离子的物质的量为1.0mol,反应后剩余水的物质的量为:10mol-1.0mol=9.0mol,
物质的量与粒子数成正比,则反应后的溶液中钠离子与水分子的个数比=1.0mol:9.0mol=1:9,
故答案为:11.2L;1:9.
点评 本题考查了物质的量的计算、化学方程式的计算,题目难度不大,明确物质的量与摩尔质量、气体摩尔体积的关系为解答关键,注意掌握守恒思想在化学计算中的应用.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
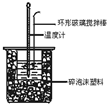 中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法不正确的是( )
中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法不正确的是( )| A. | 改用60mL 0.50mol/L盐酸跟50mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同 | |
| B. | 用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验比用 50mL0.50mol/L盐酸和50mL0.50mol/LNaOH测得的数值准确 | |
| C. | 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌 | |
| D. | 装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH═CH2 | B. | CH3-CH2-CH═CH2 | C. |  | D. | CH2═CH-CH═CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al还原性依次增强 | B. | I2、Br2、Cl2氧化性依次减弱 | ||
| C. | C、N、O原子半径依次减小 | D. | P、S、F最高正价依次降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液中加少量硫氰化钾溶液:Fe3++3SCN-═Fe(SCN)3↓ | |
| B. | 硫酸铜溶液中加过量氨水:Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+ | |
| C. | 碘化钾溶液中加过量氯水:2I-+Cl2═I2+2Cl- | |
| D. | 苯酚钠溶液中通少量CO2: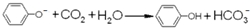 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
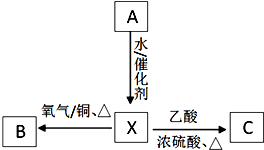 A为最简单的植物激素.有关物质的转化关系如图:
A为最简单的植物激素.有关物质的转化关系如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO-作还原剂 | |
| B. | FeO42-为还原产物 | |
| C. | 每产生1 mol FeO42-,转移3 mol电子 | |
| D. | OH-作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 [加成反应]
[加成反应]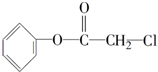 与NaOH溶液共热:
与NaOH溶液共热: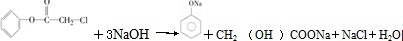 [取代反应].
[取代反应].查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com