
| 化学方程式 | K (t1) | K (t2) |
| F2+H2?2HF | 1.8×1036 | 1.9×1032 |
| Cl2+H2?2HCl | 9.7×1012 | 4.2×1011 |
| Br2+H2?2HBr | 5.6×107 | 9.3×106 |
| I2+H2?2HI | 43 | 34 |
 .
.分析 (1)温度升高,平衡常数减小,说明平衡向逆反应方向移动,HX的生成反应为放热反应;
(2)HX中H与X以一对共用电子对结合,电子式为:
(3)F、Cl、Br、I的得电子能力依次减小,故HX共价键的极性由强到弱的顺序是HF、HCl、HBr、HI;
(4)K值越大,说明反应的正向程度越大,即转化率越高,反应的正向程度越小,说明生成物越不稳定,越易分解.
解答 解:(1)由表中数据可知,温度越高平衡常数越小,这说明升高温度平衡向逆反应方向移动,所以HX的生成反应是发热反应;
故答案为:放热;
(2)HX属于共价化合物,H-X之间形成的化学键是极性共价键,因此HX的电子式是 ,故答案为:
,故答案为: ;
;
(3)F、Cl、Br、I属于ⅦA,同主族元素自上而下随着核电荷数的增大,原子核外电子层数逐渐增多,导致原子半径逐渐增大,因此原子核对最外层电子的吸引力逐渐减弱,从而导致非金属性逐渐减弱,即这四种元素得到电子的能力逐渐减弱,所以H-F键的极性最强,H-I的极性最弱,因此HX共价键的极性由强到弱的顺序是HF、HCl、HBr、HI,故答案为:HF>HCl>HBr>HI;
(4)K值越大,说明反应的正向程度越大,即转化率越高,a正确;反应的正向程度越小,说明生成物越不稳定,越易分解,因此选项d正确;而选项b、c与K的大小无直接联系.
故答案为:ad.
点评 用图表表述化学过程或呈现背景信息是化学常用的表达方式,全面考查学生分析、比较、概括、归纳问题的能力.


科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Ba2+、NO3-、SO42- | B. | K+、Na+、Cl-、ClO- | ||
| C. | Ca2+、NH4+、NO3-、Cl- | D. | K+、Na+、MnO4-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
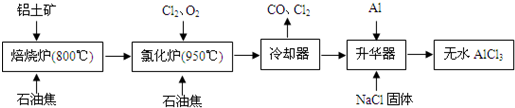
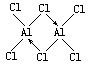 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.6 mol | B. | 1.2 mol | C. | 2.4 mol | D. | 1.8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K能从LiCl的溶液中置换出Li | |
| B. | 随着原子序数的递增,单质与水反应的剧烈程度减弱 | |
| C. | 随着原子序数的递增,单质熔点逐渐降低 | |
| D. | Cs2CO3受热易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下,0.2molFe与足量稀硫酸反应反应,生成的H2分子数目为0.3NA | |
| B. | 2 L0.5 mol×L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| C. | C2H4和N2组成的42g混合气体中原子的个数为3NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28gN2 时,转移的电子数目为3.75NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数是6 | B. | 质量数是6 | C. | 电子数是13 | D. | 中子数是13 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com