

| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
分析 (1)由图可知第ⅡA、ⅤA族元素的第一电离能有突变,因此Al的第一电离能的最小范围为Na<Al<Mg;
(2)同一主族元素原子的第一电离能I1变化规律是从上到下逐渐减小;
(3)图中第一电离能最小的元素是铷,在第五周期ⅠA族;
(4)Be(OH)2、Al(OH)3均为两性氢氧化物;
(5)运用电负性的递变规律:同周期从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小;
(6)电负性与元素性质的关系:非金属性越强,电负性越大,金属性越强,电负性越小;
(7)注意判断共价化合物的依据:两元素的电负性差值若小于1.7,形成共价键;若电负性的差值大于1.7,则形成离子键.
解答 解:(1)由图可知第ⅡA、ⅤA族元素的第一电离能有突变,因此Al的第一电离能的最小范围为Na<Al<Mg,
故答案为:Na、Mg;
(2)同一主族元素原子的从上到下,金属性增强,容易失去电子,所以第一电离能I1变化规律是从上到下逐渐减小,
故答案为:从上到下依次减小;
(3)金属性越强,越容易失去电子,所以第一电离能越小,图中第一电离能最小的元素是铷,在第五周期IA族,
故答案为:五;IA;
(4)Be(OH)2、Al(OH)3均为两性氢氧化物,都能与酸反应生成盐和水,也都能与强碱反应生成盐和水,其中Be(OH)2显示这种性质的离子方程式是Be(OH)2+2H+=Be2++2H2O,Be(OH)2+2OH-=BeO2-+2H2O;
故答案为:两;Be(OH)2+2H+=Be2++2H2O,Be(OH)2+2OH-=BeO2-+2H2O.
(5)根据电负性的递变规律:同周期从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小,可知,在同周期中电负性Na<Mg<Al,同主族Be>Mg>Ca,最小范围应为0.93~1.57,
故答案为:0.93~1.57;
(6)因电负性可以用来衡量原子吸引电子能力的大小,所以电负性越大,原子吸引电子的能力越强,非金属性越强,反之金属性越强,
故答案为:非金属性越强,电负性越大,金属性越强,电负性越小;
(7)AlCl3中Al与Cl的电负性差值为1.55,根据信息,电负性差值若小于1.7,则形成共价键,所以AlCl3为共价化合物.离子化合物在熔融状态下以离子形式存在,可以导电,但共价化合物不能导电,
故答案为:Al元素和Cl元素的电负性差值为1.55<1.7,所以形成共价键,为共价化合物;将氯化铝加热到熔融态,进行导电性实验,如果不导电,说明是共价化合物.
点评 本题考查了第一电离能的变化趋势、电离能的综合应用,题目难度中等,注意“同一周期元素中,元素第一电离能的变化趋势,及异常现象”,为易错点.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(OH-)>c(HCO3-)>c(CO32-) | B. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | ||
| C. | c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) | D. | c(Na+)>c(OH-)>c(CO32-)>c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (NH4)2CO3溶液中加过量NaOH溶液并加热:NH4++OH-=NH3•H2O | |
| B. | 金属铝溶于氢氧化钠溶液Al+2OH-=AlO2-+H2↑ | |
| C. | 用烧碱溶液吸收氯气:Cl2+OH-=Cl-+ClO-+H2O | |
| D. | 碳酸氢钠溶液与氢氧化钠溶液混合:HCO3-+OH-═H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
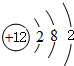 ,⑧
,⑧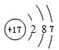
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极为铜,负极为铁,电解质溶液为FeCl3溶液 | |
| B. | 正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液 | |
| C. | 正极为铂,负极为铁,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为银,负极为铁,电解质溶液为CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
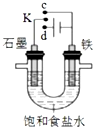
| A. | 若K与c连接,石墨电极的电极反应为:O2+4e-+4H+=2H2O | |
| B. | 若K与c连接,则溶液中的Na+向铁电极移动 | |
| C. | 若K与d连接,铁电极的电极反应为:2H++2e-═H2↑ | |
| D. | 若K与d连接,一段时间后,加适量稀盐酸可使电解质溶液复原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8gNa2O2和Na2S混合物中含有的阴离子数目为0.1NA | |
| B. | pH=13的氢氧化钾溶液,含K+数目约为0.1NA | |
| C. | 标准状况下,5.6LO2作为氧化剂时转移的电子数一定为NA | |
| D. | 18gD2O所含电子数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应 | |
| B. | 原子半径大小:X<Y,Z>W | |
| C. | 化合物Z2Y和ZWY3都只存在离子键 | |
| D. | Y,W的某些单质或两元素之间形成的某些化合物可作水的消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机物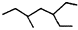 的系统命名为:3-乙基-5-甲基庚烷 的系统命名为:3-乙基-5-甲基庚烷 | |
| B. | 用Na2CO3溶液能区分CH3COOH、CH3CH2OH、苯、硝基苯四种物质 | |
| C. | 等质量的丁烷、丁烯、1,3-丁二烯分别充分燃烧,所耗氧气的量依次增加 | |
| D. | 糖类、油脂、蛋白质都属于天然有机高分子化合物,都能发生水解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com