
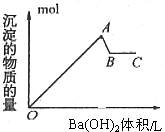
| A. | OA段的反应离子方程式为:2Al3++3SO42-+3Ba2++6OH-→2Al(OH)3↓+3BaSO4↓ | |
| B. | AB段的离子方程式只有:Al(OH)3+OH-→AlO2-+2H2O | |
| C. | A点的沉淀为Al(OH)3和BaSO4的混合物 | |
| D. | B点溶液为KAlO2溶液 |
分析 向明矾溶液里滴加氢氧化钡溶液,开始到生成沉淀的物质的量最大时:2Al3++3SO42-+3Ba2++6OH-→2Al(OH)3↓+3BaSO4↓;继续加氢氧化钡,当硫酸根离子恰好沉淀完全时,发生KAl(SO4)2+2Ba(OH)2═2BaSO4↓+KAlO2+2H2O,以此来解答.
解答 解:向明矾溶液里滴加氢氧化钡溶液,开始到生成沉淀的物质的量最大时:2Al3++3SO42-+3Ba2++6OH-→2Al(OH)3↓+3BaSO4↓;继续加氢氧化钡,当硫酸根离子恰好沉淀完全时,发生KAl(SO4)2+2Ba(OH)2═2BaSO4↓+KAlO2+2H2O,
A.OA段生成沉淀的物质的量最大,反应离子方程式为:2Al3++3SO42-+3Ba2++6OH-→2Al(OH)3↓+3BaSO4↓,故A正确;
B.AB段氢氧化铝溶解,钡离子与硫酸根离子生成沉淀,则离子方程式为2SO42-+2Ba2++Al(OH)3+OH-=AlO2-+2BaSO4↓+2H2O,故B错误;
C.OA段生成沉淀的物质的量最大,沉淀为Al(OH)3和BaSO4的混合物,故C正确;
D.AB段氢氧化铝溶解,SO42-全部转化为BaSO4,则B点溶液为KAlO2,故D正确.
故选B.
点评 本题考查离子反应、离子方程式的书写等,明确硫酸根离子完全沉淀时消耗的氢氧化钡的量是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | C | N | F | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
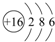 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述实验中不能用盐酸代替硫酸 | |
| B. | 将试管充分振荡后静置,溶液颜色变为紫色 | |
| C. | 在酸性条件下,PbO2的氧化性比MnO4-的氧化性强 | |
| D. | 若硫酸锰充分反应,消耗PbO2的物质的量为0.01mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
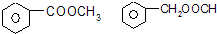 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 6.02×1023 | B. | 12C原子质量的十二分之一 | ||
| C. | 0.012Kg12C所含的原子数 | D. | 1mol氧气所含的微粒数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
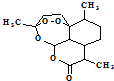 ,有关叙述正确的是d(选填序号).
,有关叙述正确的是d(选填序号).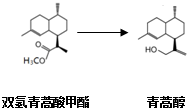
| 物质 | 性质 |
| 双氢青蒿酸甲酯(C16H28O2) | 固体,难溶于水,易溶于有机溶剂. |
| 青蒿醇(C15H28O) | 固体,难溶于水,易溶于有机溶剂. |
| 乙醚 | 无色液体,微溶于水;密度0.71g/cm3;沸点:34.6℃. |
| 氢化铝锂 | 固体,溶于乙醚. 与水反应:LiAlH4+4H2O→Al(OH)3↓+LiOH+4H2↑ 可将一分子酯还原成二分子醇,自身生成醇铝、醇锂. (醇铝、醇锂可与盐酸反应,生成铝盐、锂盐和相应的醇). |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若晶体熔融状态下能导电,该晶体一定是离子晶体 | |
| B. | 若晶体熔化时化学键断裂,该晶体一定是原子晶体 | |
| C. | 若晶体中含有非极性分子,该晶体可能有较低的熔沸点 | |
| D. | 若晶体中含有极性共价键,该晶体不可能有很高的熔沸点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com