
分析 (1)氯化铝是强酸弱碱盐,铝离子水解生成HCl,生成的HCl水溶液以挥发,升高温度促进其挥发,所以蒸干溶液得到氢氧化铝固体,灼烧氢氧化铝固体时其易分解;
(2)Na2CO3水解生成的OH-,能和和玻璃中的SiO2反应生成粘性物质Na2SiO3;
(3)硫酸铝和碳酸氢钠能发生双水解反应生成氢氧化铝沉淀和二氧化碳气体;
(4)将0.01molCH3COONa和0.02mol盐酸溶于水,得到0.01molCH3COOH、0.01molNaCl,0.01molHCl,HCl、NaCl为强电解质,CH3COOH为弱电解质,混合溶液中有酸,导致溶液呈酸性.
解答 解:(1)AlCl3在加热时水解生成Al(OH)3和HCl,HCl易挥发,蒸干灼烧得到Al2O3,故答案为:Al2O3
;
(2)Na2CO3水解生成的OH-,能和和玻璃中的SiO2反应生成粘性物质Na2SiO3而黏住瓶口,所以不能用玻璃塞试剂瓶盛放碳酸钠溶液,
故答案为:Na2CO3水解生成的OH-能够和玻璃中的SiO2反应,生成的Na2SiO3会粘住瓶口;
(3)硫酸铝和碳酸氢钠能发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(4)将0.01molCH3COONa和0.02mol盐酸溶于水,得到0.01molCH3COOH、0.01molNaCl,0.01molHCl,HCl、NaCl为强电解质,CH3COOH为弱电解质,
则溶液中存在的离子为:Na+、H+、Cl-、OH-、CH3COO-,存在的分子为:H2O、CH3COOH,即共有7种不同的微粒;HCl、NaCl为强电解质完全电离,CH3COOH为弱电解质部分电离,则各离子浓度从大到小的顺序为c(Cl-)>c(H+)>c(Na+)>c(CH3COO-)>c(OH-);
故答案为:7;c(Cl-)>c(H+)>c(Na+)>c(CH3COO-)>c(OH-).
点评 本题考查了离子浓度大小比较、盐类水解原理及盐类水解应用,为高频考点,明确盐的性质及盐类水解原理是解本题关键,易错题是(4)题,知道该混合溶液中溶质成分及其物质的量,难点是离子浓度大小顺序排列,题目难度中等.


科目:高中化学 来源: 题型:解答题
 现有含有少量KCl、K2SO4、K2CO3杂质的KNO3溶液,选择适当的试剂除去杂质,得到纯净的KNO3固体,实验流程如图所示.
现有含有少量KCl、K2SO4、K2CO3杂质的KNO3溶液,选择适当的试剂除去杂质,得到纯净的KNO3固体,实验流程如图所示.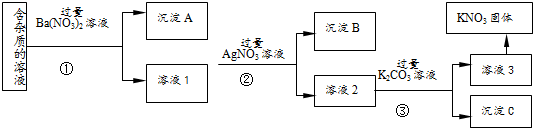
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤⑥⑦ | B. | ①③④⑤ | C. | ①②③④⑤⑦ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将NaOH溶液逐滴加入饱和的FeCl3溶液中制取Fe(OH)3胶体 | |
| B. | 氯气泄漏后应顺风向低处跑 | |
| C. | 金属钠着火立刻用湿布盖灭 | |
| D. | 做完焰色反应实验的铂丝用稀盐酸清洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡逆向移动 | B. | 混合气体颜色比原来深 | ||
| C. | 混合气体颜色比原来浅 | D. | 混合气体的平均相对分子质量变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述三个反应都有单质生产,所以都是置换反应 | |
| B. | 氧化性由强到弱的顺序为KBrO3>KClO3>Cl2>Br2 | |
| C. | 反应①中还原剂与氧化剂的物质的量之比为6:1 | |
| D. | 若反应②中有1 mol还原剂参加反应,则氧化剂得电子的物质的量为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com