
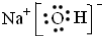
分析 (1)氢氧化钠是离子化合物,氢氧根和钠离子之间是离子键,氢氧根离子中氧原子与氢原子之间是共价键,据此写电子式;
(2)二氧化硫具有还原性,能被硝酸氧化,盐酸中的氯化氢易挥发,制得的二氧化硫不纯,根据制二氧化硫的速率判断选择硫酸的浓度;
(3)SO2气体通入甲酸钠的碱性溶液可以生成Na2S2O4,根据元素守恒和电子得失守恒写化学方程式;
(4)根据电子得失守恒可知,保险粉与重铬酸根离子反应的关系式为Cr2O72-~Na2S2O4,据此计算;
(5)保险粉分解生成甲、乙、丙三种化合物,若将甲、乙两种物质分别配成溶液,在甲溶液中加入稀硫酸,则有淡黄色沉淀和气体丙产生,则甲应为Na2S2O3,乙溶液中加入BaCl2溶液和稀盐酸,有气体丙产生,但无白色沉淀,则乙为Na2SO3,据此答题;
(6)若证明溶液中有SO42-存在,即可证明氧化时发生的是②的反应.
解答 解:(1)氢氧化钠是离子化合物,氢氧根和钠离子之间是离子键,氢氧根离子中氧原子与氢原子之间是共价键,所以氢氧化钠的电子式为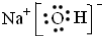 ,
,
故答案为: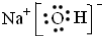 ;
;
(2)二氧化硫具有还原性,能被硝酸氧化,盐酸中的氯化氢易挥发,制得的二氧化硫不纯,70%的H2SO4产生二氧化硫的速率较快,
故选B;
(3)SO2气体通入甲酸钠的碱性溶液可以生成Na2S2O4,反应的化学方程式为NaOH+HCOONa+2SO2=Na2S2O4+CO2+H2O,
故答案为:NaOH+HCOONa+2SO2=Na2S2O4+CO2+H2O;
(4)根据电子得失守恒可知,保险粉与重铬酸根离子反应的关系式为Cr2O72-~Na2S2O4,所以每消耗0.1mol保险粉,理论上可以除去Cr2O72-的物质的量为0.1mol,
故答案为:0.1;
(5)保险粉分解生成甲、乙、丙三种化合物,若将甲、乙两种物质分别配成溶液,在甲溶液中加入稀硫酸,则有淡黄色沉淀和气体丙产生,则甲应为Na2S2O3,乙溶液中加入BaCl2溶液和稀盐酸,有气体丙产生,但无白色沉淀,则乙为Na2SO3,甲溶液中加入稀硫酸后所发生反应的离子方程式为S2O32-+2H+=SO2+S↓+H2O,根据元素守恒,保险粉分解的化学方程式为 2 Na2S2O4=Na2S2O3+Na2SO3+SO2,
故答案为:S2O32-+2H+=SO2+S↓+H2O; 2 Na2S2O4=Na2S2O3+Na2SO3+SO2;
(6)若证明溶液中有SO42-存在,即可证明氧化时发生的是②的反应,实验操作为取少许固体溶于水中,加入BaCl2溶液,有白色沉淀产生,则证明是②,
故答案为:取少许固体溶于水中,加入BaCl2溶液,有白色沉淀产生,则证明是②.
点评 本题考查了硫及其化合物性质的分析判断,离子方程式的书写方法,氧化还原反应计算应用,实验原理的分析等,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1mol氦气中有2NA个氦原子 | B. | 7g氮气中含有NA个氮原子 | ||
| C. | 0.3 mol Na2SO4中含有0.6NA个Na+ | D. | 18g水中所含的电子数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
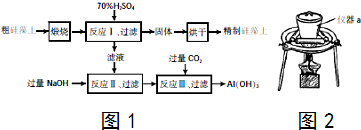
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
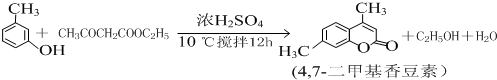
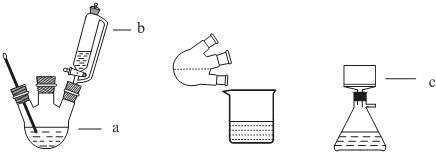
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同浓度稀溶液pH:碳酸>苯酚>乙酸 | B. | 离子半径:O2->F->Na+>Mg2+ | ||
| C. | 晶体熔点:SiO2>P4>NaCl | D. | 沸点:HF<HCl<HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
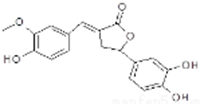
| A. | 分子中含有三种含氧官能团 | |
| B. | 1mol该化合物最多能与6molNaOH反应 | |
| C. | 既可以发生取代反应,又能够发生加成反应 | |
| D. | 能与FeC13发生显色反应,但不能和NaHCO3反应放出CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com