
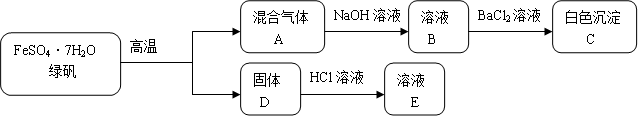
分析 FeSO4•7H2O高温分解得到固体D,固体D是一种红色氧化物为铁的氧化物判断为Fe2O3,溶于盐酸溶液得到E溶液为氯化铁溶液,混合气体A通入氢氧化钠溶液得到溶液B,加入氯化钡生成白色沉淀C为BaSO4,则A中含有SO3,结合盐酸化合价变化可知铁元素化合价升高,硫元素化合价降低,所以A气体中一定含有SO2,杯水沉淀中还有BaSO3,
(1)分析可知B溶液中含有硫酸钠和亚硫酸钠;
(2)白色沉淀C中加入盐酸,亚硫酸钡和盐酸溶解生成二氧化硫气体;
(3)固体D为氧化铁和盐酸反应生成氯化铁溶液.
解答 解:FeSO4•7H2O高温分解得到固体D,固体D是一种红色氧化物为铁的氧化物判断为Fe2O3,溶于盐酸溶液得到E溶液为氯化铁溶液,混合气体A通入氢氧化钠溶液得到溶液B,加入氯化钡生成白色沉淀C为BaSO4,则A中含有SO3,结合盐酸化合价变化可知铁元素化合价升高,硫元素化合价降低,所以A气体中一定含有SO2,杯水沉淀中还有BaSO3,
(1)分析可知,混合气体A通入足量NaOH溶液后,溶液B中属于盐的溶质有硫酸钠和亚硫酸钠,化学式为:Na2SO3; Na2SO4,
故答案为:Na2SO3; Na2SO4;
(2)白色沉淀C中加入盐酸,亚硫酸钡和盐酸溶解生成二氧化硫气体,反应的现象为沉淀部分溶解且有气体生成,
故答案为:沉淀部分溶解且有气体生成;
(3)固体D为氧化铁和盐酸反应生成氯化铁溶液,反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O,
故答案为:Fe2O3+6H+=2Fe3++3H2O.
点评 本题考查了物质性质、物质转化、物质反应的特征现象等知识,掌握基础是解题关键,题目难度中等.


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验现象 | 推论 |
| A | 乙烯气体可以使溴水褪色 | 乙烯发生取代反应 |
| B | 浓硫酸电导率比较低 | 硫酸浓度大时是弱电解质 |
| C | 氨气用于喷泉实验 | 氨气极易溶于水 |
| D | 硝酸溶液使pH试纸先变红后变白 | 硝酸酸性太强不能用pH试纸检测 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 组分名称 | SiCl4 | SiHCl3 | SiH2Cl2 | HCl | BCl3 | PCl3 |
| 质量分数 | 0.545 | 0.405 | 0.0462 | 0.0003 | 0.00193 | 0.00157 |
| 沸点/℃ | 57.6 | 31.8 | 8.2 | -85 | 12.5 | 75.5 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X(g)+Y(g)?CH3OH(g)+D(g) (未配平) | A(g)+B(g)?2C(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 用品 |  |  |  |  |
| 主要成分 | H2O2 | Na2CO3 | Al(OH)3 | NaCl |
| 用途 | 消毒剂 | 发酵粉 | 抗酸药 | 调味品 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 外加直流电源保护钢闸门时,钢闸门与电源的负极相连 | |
| B. | 铅蓄电池在放电过程中,负极质量增加,正极质量减少 | |
| C. | 锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 | |
| D. | t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,K值及SO2转化率不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com