
| A. | 该反应达到平衡时,放出的热量等于92.4KJ | |
| B. | 达到平衡后向容器中通入1mol氦气,平衡不移动 | |
| C. | 降低温度和缩小容器体积均可使该反应的平衡常数增大 | |
| D. | 若达到平衡时N2的转化率为20%,则平衡时容器内的压强是起始时的80% |
分析 A.反应为可逆反应,不能完全转化;
B.容积不变,通入1mol氦气,反应体积中各物质的浓度不变;
C.该反应为放热反应,降低温度平衡正向移动,K只与温度有关;
D.平衡时N2的转化率为20%,则反应的氮气为0.2mol,反应达到平衡,气体总物质的量减少0.4mol,结合压强之比等于物质的量之比计算.
解答 解:A.反应为可逆反应,不能完全转化,则加入1mol N2和3mol H2发生反应达到平衡时,放出的热量小于92.4KJ,故A错误;
B.容积不变,通入1mol氦气,反应体积中各物质的浓度不变,则平衡不移动,故B正确;
C.该反应为放热反应,降低温度平衡正向移动,K增大,而K只与温度有关,则缩小容器体积平衡常数K不变,故C错误;
D.平衡时N2的转化率为20%,则反应的氮气为0.2mol,反应达到平衡,气体总物质的量减少0.4mol,由压强之比等于物质的量之比可知,平衡时容器内的压强是起始时的$\frac{4-0.4}{4}$×100%=90%,故D错误.
故选:B.
点评 本题考查化学平衡的影响因素,把握浓度、温度、稀有气体对反应的影响即可解答,注意选项C为易错点,明确可逆反应的特点及平衡常数只与温度有关,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应除了生成新物质外,还伴随着能量的变化 | |
| B. | 水汽化需要吸收能量,所以水汽化属于吸热反应 | |
| C. | 所有的化合反应都是放热反应 | |
| D. | 1 mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol/L | B. | 1.0mol/L | C. | 1.5mol/L | D. | 2.0mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
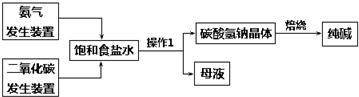
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
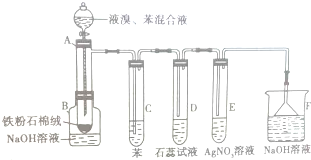 如图为探讨苯和液溴反应改进的实验装置图,其中A为具支试管改制成的反应容器,在其下端开了一个小孔,并塞好石棉绒,实验时先加少量铁粉于石棉绒上,填写下列空白:
如图为探讨苯和液溴反应改进的实验装置图,其中A为具支试管改制成的反应容器,在其下端开了一个小孔,并塞好石棉绒,实验时先加少量铁粉于石棉绒上,填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
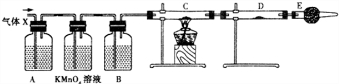
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com