
分析 根据m=nM、N=nNA计算,根据水分子的组成,含有10个质子计算出1mol水中含有的质子数;1molH2SO4中含2mol的氢原子,结合N=nNA计算.
解答 解:1mol水中含有水分子的个数为:N(H2O)=1mol×6.02×1023=6.02×1023;含有氢原子的物质的量为:2mol;含有的质子的物质的量为1mol×10=10mol,0.5mol H2SO4中含氢原子的物质的量为0.5mol×2=1mol,所以0.5mol H2SO4中含6.02×1023个H,故答案为:6.02×1023;2;10;6.02×1023.
点评 本题主要考查了物质的量的计算,注意粒子间的关系,难度不大,比较容易.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:解答题
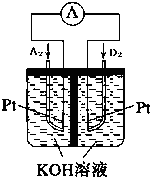 A、B、C、D、E、F、G均为短周期元素,原子序数依次递增.A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素.请用化学用语回答:
A、B、C、D、E、F、G均为短周期元素,原子序数依次递增.A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素.请用化学用语回答: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x) kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| D. | CO2(g)+2NaOH(l)═2NaHCO3(l)△H=-(8x-2y) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量NaHCO3、Na2CO3分别与同浓度盐酸完全反应,消耗的盐酸体积Na2CO3是NaHCO3的二倍 | |
| B. | Na2O2和Na2O均可以和盐酸反应生成相应的盐,都属于碱性氧化物 | |
| C. | 将澄清石灰水分别加入NaHCO3和Na2CO3两种盐溶液中,只有Na2CO3溶液产生沉淀 | |
| D. | Na2O2和Na2O中Na2O更稳当,Na2O2在一定条件下可以转化为Na2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| Ⅰ | Cu、稀HNO3 | H2O | |
| Ⅱ | NaOH固体、浓氨水 | NH3 | |
| Ⅲ | 镁铝合金、足量NaOH溶液 | H2 | H2O |
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 376.6mL |
| ② | 1.0g | 10.0mL | 364.7mL |
| ③ | 1.0g | 10.0mL | 377.0mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸一般要保存棕色试剂瓶中,置于阴凉处,原因是:4HNO3$\frac{\underline{\;见光或受热\;}}{\;}$2NO2↑+O2↑+2H2O | |
| B. | 配制240ml浓度为1 mol•L-1的NaOH溶液,需将NaOH固体放在烧杯中,用托盘天平称取10.00g,选用250ml的容量瓶进行配制 | |
| C. | 常温下可用铁质或铝制容器储运浓硝酸,是因为常温下二者不发生反应 | |
| D. | 铵盐在加热时都会分解产生氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
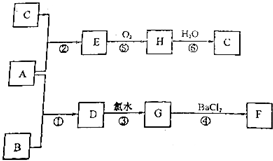
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com