
| A、CaO+CO2=CaCO3 | ||||
B、CH3CH2OH+3O2
| ||||
| C、灼热的木炭与CO2的反应 | ||||
| D、Ba(OH)2?8H2O晶体与NH4Cl晶体的反应 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
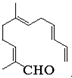 从甜橙的芳香油中可分离得到如图结构的化合物.现有试剂:①KMnO4酸性溶液;②新制Cu(OH)2;③Ag(NH3)2OH;④H2/Ni,能与该化合物中所有官能团都发生反应的试剂有( )
从甜橙的芳香油中可分离得到如图结构的化合物.现有试剂:①KMnO4酸性溶液;②新制Cu(OH)2;③Ag(NH3)2OH;④H2/Ni,能与该化合物中所有官能团都发生反应的试剂有( )| A、①② | B、②③ | C、③④ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中的相对位置如表所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子.它们之间的转化关系如图所示.
A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中的相对位置如表所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子.它们之间的转化关系如图所示.| B | D | |
| E |
查看答案和解析>>
科目:高中化学 来源: 题型:


 和
和 ,鉴别I和J的试剂为
,鉴别I和J的试剂为查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | NaOH起始读数 | NaOH终点读数 |
| 第一次 | 0.10mL | 18.60mL |
| 第二次 | 0.30mL | 18.00mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| B、c(OH-)=c(CH3COO-)+c(H+) |
| C、c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应温度 | Na2S2O3 | H2SO4 | H2O | |||
| ℃ | V(mL) | c(mol?L-1) | V(mL) | c(mol?L-1) | V(mL) | |
| A | 10 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 10 | 5 | 0.1 | 5 | 0.1 | 10 |
| C | 30 | 5 | 0.1 | 5 | 0.1 | 10 |
| D | 30 | 5 | 0.2 | 5 | 0.2 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:


| 实验方法 | 实验现象 | 结论 |
| 步骤1:在滤液A中加入 | 滤液A中有Fe3+ | |
| 步骤2:在滤液A中加入 | 滤液A中有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如下图,在试管a中先加入2mL95%的乙醇,边摇动边缓缓加入5mL浓H2SO4并充分摇匀,冷却后再加入2g无水醋酸,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.
如下图,在试管a中先加入2mL95%的乙醇,边摇动边缓缓加入5mL浓H2SO4并充分摇匀,冷却后再加入2g无水醋酸,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.| 物 质 | 检验试剂 | 除杂试剂 |
| 甲烷(乙烯) | ||
| 酒 精(水) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com