
| A. | 苯中含苯酚杂质:加入溴水,过滤 | |
| B. | 乙醇中含氯乙烷杂质:加入水,萃取分液 | |
| C. | 乙醛中含乙酸杂质:加入碳酸钠溶液洗涤,分液 | |
| D. | 乙酸丁酯中含乙酸杂质:加入NaOH溶液洗涤,分液 |
分析 A.溴、三溴苯酚均易溶于苯;
B.乙醇与水互溶,但氯乙烷不溶于水;
C.乙酸与碳酸钠反应后,与乙醛不分层;
D.乙酸丁酯、乙酸均与NaOH溶液反应.
解答 解:A.溴、三溴苯酚均易溶于苯,不能除杂,应加NaOH溶液、分液,故A错误;
B.乙醇与水互溶,但氯乙烷不溶于水,则加入水,萃取分液可除杂,故B正确;
C.乙酸与碳酸钠反应后,与乙醛不分层,则不能分液分离,应选蒸馏法,故C错误;
D.乙酸丁酯、乙酸均与NaOH溶液反应,不能除杂,应加饱和碳酸钠溶液、分液,故D错误;
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及混合物分离提纯方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
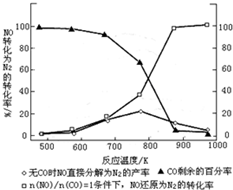 乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
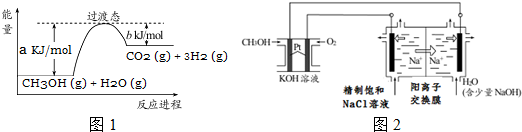
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅是酸性氧化物,它不溶于任何酸 | |
| B. | 高纯度的硅单质广泛用于制作光导纤维 | |
| C. | 二氧化碳通入水玻璃可以制得硅酸 | |
| D. | 水泥、玻璃、水晶饰物都是硅酸盐制品 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
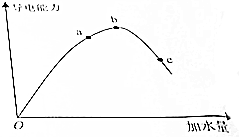 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示,请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水分子中共价键比氯化钠中离子键弱 | |
| B. | 水的相对分子质量比氯化钠的小 | |
| C. | 水分子间有范德华力,氯化钠分子间的作用力较强 | |
| D. | 水分子间是以范德华力相结合,相互作用较弱;氯化钠晶体中,Na+和Cl-以离子键相结合,作用力较强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com