
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.
| a |
| ||||||||||||||||
| b | c | d | e | f |
| ||||||||||||
| g | h | i | j | k | l | m |
| ||||||||||
| n | o |
试回答下列问题:
(1)请写出字母O代表的元素符号 ,该元素在周期表中的位置 .
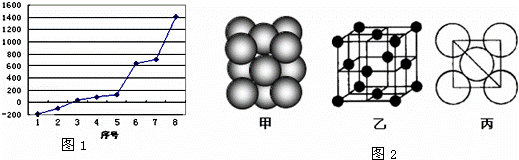
(2)第三周期8种元素按单质熔点高低的顺序如右图,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填如图1中的序号).
(3)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.两者相比熔点更高的是 (填化学式),试从结构角度加以解释: .
(4)k与l形成的化合物kl2的电子式是 ,它在常温下呈液态,形成晶体时,属于 晶体.
(5)i单质晶体中原子的堆积方式如图2(甲)所示,其晶胞特征如图2(乙)所示,原子之间相互位置关系的平面图如图2(丙)所示.若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
一个晶胞中i原子的数目为 ,该晶体的密度_ (用M、NA、d表示).
(6)a与d构成的阳离子和i的阳离子可与硫酸根形成一种复盐,向该盐的浓溶液中逐滴加入浓氢氧化钡溶液,产生的现象有:①溶液中出现白色沉淀并伴有有刺激性气味气体放出,②沉淀逐渐增多后又逐渐减少直至最终沉淀的量不变.写出沉淀的量不变时发生反应的离子方程式 .
考点:
元素周期律和元素周期表的综合应用;元素电离能、电负性的含义及应用;晶体熔沸点的比较;晶胞的计算.
专题:
元素周期律与元素周期表专题;化学键与晶体结构.
分析:
根据元素周期表知,a﹣o各元素分别是H、Li、C、N、O、F、Na、Mg、Al、Si、S、Cl、Ar、K、Fe.
(1)铁属于第四周期 第VIII族.
(2)第三周期8种元素的单质中只有Si为原子晶体,熔沸点最大,熔沸点为原子晶体>金属晶体>分子晶体,分子晶体有氩、氯气、S、磷,在分子晶体中Ar只有分子间作用力,沸点最低,氯气、S、磷中只有氯气为气体,其熔沸点在三者中最小.
根据晶体类型判断物质的熔沸点高低,单质熔沸点高低顺序为:原子晶体>金属晶体>分子晶体;非金属性越强的元素其电负性越大.
(3)原子晶体中,键长越短,化学键越强,物质的熔点越高.
(4)k与l形成的化合物kl2是共价化合物,原子之间形成共价键,根据共价化合物电子式的书写规则书写;常温下呈液态的物质形成的晶体为分子晶体.
(5)利用均摊法计算晶胞中含有的原子个数;先根据已知的原子半径计算晶胞的体积,根据该原子的相等原子质量计算晶胞中含有原子的质量,再根据密度公式计算其密度.
(6)a与d构成的阳离子是铵根离子,i的阳离子是铝离子,a与d构成的阳离子和i的阳离子可与硫酸根形成一种复盐,向该盐的浓溶液中逐滴加入浓氢氧化钡溶液,产生的现象有①溶液中出现白色沉淀并伴有有刺激性气味气体放出,说明生成氢氧化铝和氨气;②沉淀逐渐增多后又逐渐减少直至最终沉淀的量不变说明生成偏铝酸盐和硫酸钡.
解答:
解:根据元素周期表知,a﹣o各元素分别是H、Li、C、N、O、F、Na、Mg、Al、Si、S、Cl、Ar、K、Fe.
(1)通过以上分析知:O是Fe元素,在周期表中处于第四周期、第VIII族.
故答案为:Fe元素;第四周期、第VIII族.
(2)第三周期8种元素的单质中只有Si为原子晶体,熔沸点最大,由图可知序号“8”代表的为Si,分子晶体的沸点较低,非金属性越强的电负性越大,分子晶体有氩、氯气、S、磷,在分子晶体中Ar只有分子间作用力,沸点最低,氯气、S、磷中只有氯气为气体,其熔沸点在三者中最小,由图可知,序号“2”代表的为Cl,其电负性最大,
故答案为:Si;2.
(3)由j原子跟c原子以1:1相互交替结合而形成的晶体为SiC,SiC晶型与晶体Si相同,都是原子晶体,由于C的原子半径小,SiC中C﹣Si键键长比晶体Si中Si﹣Si键长短,C﹣Si键能大,因而SiC晶体熔沸点高.
故答案为:Si﹣C;因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中C﹣Si键键长比晶体Si中Si﹣Si键长短,键能大,因而熔沸点高.
(4)k与l形成的化合物kl2是SCl2,硫原子一氯原子之间形成1对共用电子对,电子式为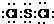 ;SCl2常温下呈液态,SCl2属于分子晶体.
;SCl2常温下呈液态,SCl2属于分子晶体.
故答案为: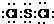 ;分子晶体.
;分子晶体.
(5)由晶胞结构可知,晶胞中i原子的数目为8×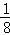 +6×
+6×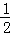 =4;由信息可知晶胞图可知为面心立方,设棱长为x,所以2x2=(4d)2,所以x=2
=4;由信息可知晶胞图可知为面心立方,设棱长为x,所以2x2=(4d)2,所以x=2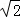 d,即正方体的棱长为2
d,即正方体的棱长为2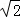 d,正方体的体积为16
d,正方体的体积为16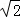 d3,该晶胞中原子的质量=4
d3,该晶胞中原子的质量=4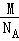 ,所以其密度=
,所以其密度= =
=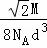 .
.
故答案为:4;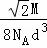 .
.
(6)a与d构成的阳离子是铵根离子,i的阳离子是铝离子,a与d构成的阳离子和i的阳离子可与硫酸根形成一种复盐,向该盐的浓溶液中逐滴加入浓氢氧化钡溶液,产生的现象有①溶液中出现白色沉淀并伴有有刺激性气味气体放出,说明生成氢氧化铝、硫酸钡和氨气;②沉淀逐渐增多后又逐渐减少直至最终沉淀的量不变说明氢氧化铝和氢氧化钡反应生成偏铝酸盐,所以离子方程式为:NH4++Al3++5OH﹣+2SO42﹣+2Ba2+=NH3↑+3H2O+AlO2﹣+2BaSO4↓.
故答案为:NH4++Al3++5OH﹣+2SO42﹣+2Ba2+=NH3↑+3H2O+AlO2﹣+2BaSO4↓.
点评:
本题考查了晶体类型与单质熔沸点的关系、晶体的密度等知识点,难点是计算晶体的密度,能正确确定晶胞中含有的原子个数及晶胞的体积是解其题的关键;明确相同类型的晶体中熔沸点高低的判断方法.


科目:高中化学 来源: 题型:
不能说明X的电负性比Y的大的是( )
|
| A. | 与H2化合时X单质比Y单质容易 |
|
| B. | X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 |
|
| C. | X原子的最外层电子数比Y原子的最外层电子数多 |
|
| D. | X单质可以把Y从其氢化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,正确的是( )
|
| A. | 在一个基态多电子的原子中,可以有两个运动状态完全相同的电子 |
|
| B. | 在一个基态多电子的原子中,不可能有两个能量完全相同的电子 |
|
| C. | 在一个基态多电子的原子中,M层上的电子能量肯定比L层上的电子能量高 |
|
| D. | 如果某一基态3p能级上仅有2个电子,它们自旋方向必然相反 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在相同的温度和压强下,4个容器中分别装有4种气体.已知各容器中的气体和容器的容积分别是a.CO2 10L;b.O2 20L;c.N2 40L;d.CH460L.则4个容器中气体的质量由大到小的顺序是()
A. a>b>c>d B. b>a>d>c C. c>d>b>a D. d>c>a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
由硫酸钾、硫酸铝和硫酸组成的混合溶液,其中c(H+)=0.1mol/L,c(Al3+)=0.4mol/L,c(SO42﹣)=0.8mol/L,则c(K+)为()
A. 0.15 mol/L B. 0.2 mol/L C. 0.3 mol/L D. 0.4 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2﹣具有相同的电子层结构,W与X同主族,下列说法正确的是()
A. 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X)
B. Y分别与Z、W形成的化合物中化学键类型相同
C. X的最高氧化物对应的水化物的酸性比W的弱
D. Y的气态简单氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应前后物质的总能量变化可用如图表示的是()
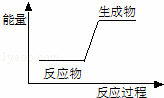
A. H﹣F═H+F B. Mg+2H+=Mg2++H2↑
C. 2Na+2H2O=2Na++2OH﹣+H2↑ D. HNO3+NaOH=NaNO3+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com