
【题目】将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol·L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是

A. x=2.24
B. 铝的物质的量为0.2 mol
C. 反应时,Na、Mg、Al均过量
D. 曲线b为Mg与盐酸反应的图像
【答案】C
【解析】试题分析:由于最后生成的气体量相同,所以这些金属置换出的氢气量相等,即等物质的量的三种金属失去了相同数量的电子,而若盐酸过量的话,这些金属失去的电子数因该是不一样的,比值应是1:2:3,所以推断出盐酸不可能过量,但可能刚好和Na反应完全,此时Na完全反应而Mg、Al还有剩余,A.由于酸不足,所以生成氢气的量为:n(H2)=1/2n(HCl)=0.1×2÷2=0.1mol,所以标况下的体积为2.24L,A项正确;B.生成0.1mol的氢气需0.2mol的钠,B项正确;C.Na不可能过量,若Na过量会与溶剂水反应,C项错误;D.按照金属活动性顺序,Na>Mg>Al,则中间那条线是Mg与盐酸反应的图象,D项正确;答案选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】医学证明人类牙齿由一层称为碱式磷酸钙的坚硬物质保护着。碱式磷酸钙的化学式中除钙离子外,还含有一个氢氧根离子和三个磷酸根离子,则其化学式正确的是
A.Ca5(OH)(PO4)3 B.Ca4(OH)(PO4)3 C.Ca3(OH)(PO4)3 D.Ca2(OH)(PO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中所用仪器合理的是
A. 用100mL容量瓶配制70mL0.1mol/L盐酸 B. 用托盘天平称取25.20g氯化钠
C. 用20mL的量筒量取13.86mL NaOH溶液 D. 用蒸发皿加热胆矾晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F属于短周期主族元素.A的原子半径是短周期中最大,B元素的原子最外层电子数为m、次外层电子数为n,C元素的原子L层电子数为m+n, M层电子数为m﹣n,D元素与C元素同主族,E元素原子与B元素原子的核外电子数之比为2:1,F的一种原子中,质量数与质子数之差为零.
(1)写出元素的名称C________E________F________.
(2)C在周期表中的位置是________
(3)A2B2的电子式为______.
(4)A、B形成的简单离子的半径由大到小的顺序为________.(用对应的化学符号填空,下同)
(5)A、E形成的是________(填共价或离子)化合物
(6)B、E两种元素形成的气态氢化物中稳定性更强的是______;
(7)由元素C形成的单质Y与由A、B、F三种元素形成的化合物X的水溶液反应的离子方程式为___________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组物质中,Y既能与X反应又能与Z反应的是
X | Y | Z | |
① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
② | KOH溶液液 | Na2CO3 | 稀盐酸 |
③ | CO2 | Na2O2 | H2O |
④ | FeCl3溶液 | Cu | 稀硫酸 |
A. ①③ B. ①④ C. ②④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 kJ。该反应的热化学方程式为_____________。
(2)反应AX3(g)+X2(g)===AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
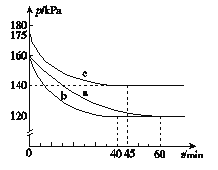
① 列式计算实验a从反应开始至达到平衡时的反应速率v(AX5)=__________。
② 图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为 (填实验序号);与实验a相比,实验b改变的实验条件及判断依据是 。
③ 用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为__________;实验a和c的平衡转化率:αa为________,αc为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)通常用作火箭的高能燃料,N2O4 作氧化剂。请回答下列问题:
⑴已知:N2(g)+2O2(g)=2NO2(g) △H=+a kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-b kJ/mol
2NO2(g)![]() N2O4(g) △H=-c kJ/mol
N2O4(g) △H=-c kJ/mol
写出气态肼在气态 N2O4 中燃烧生成氮气和气态水的热化学方程式 。
⑵工业上常用次氯酸钠与过量的氨气反应制备肼,该反应的化学方程式为 。
⑶N2、H2 合成氨气为放热反应。800K 时向下列起始体积相同的密闭容器中充入 2mol N2、3mol H2, 甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙是绝热容器,三容器各自建立化学平衡。

达到平衡时,平衡常数 K 甲 K 乙(填“﹥”“﹤”或“=”)。
② 达到平衡时 N2 的浓度 c(N2)乙 c(N2)丙(填“﹥”“﹤”或“=”)。
③ 对甲、乙、丙三容器的描述,下列说法正确的是
A. 乙容器气体密度不再变化时,说明此反应已达到平衡状态
B. 在甲中充入稀有气体 He,化学反应速率加快
C. 将甲中的活塞往下压至原体积的一半,平衡向右移动
D.丙容器温度不再变化时说明已达平衡状态
⑷ 氨气通入如图电解装置可以辅助生产 NH4NO3,该电解池阴极反应式为 。

⑸ 在 20mL 0.2mol/L 的 NH4NO3 溶液中加入 10mL 0.2mol/L NaOH 溶液后显碱性,溶液中所有离子浓度大小关系为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是 ( )

A. 原子半径:rW>rZ>rY>rX
B. 含Y元素的硫酸盐溶液可以和强酸、强碱反应
C. 最简单气态氢化物的热稳定性:Z>W
D. X的氢化物与X的最高价氧化物对应的水化物能形成离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com