
| A、食用加碘盐可预防碘缺乏症,加碘盐中加的含碘物质是碘单质 |
| B、因为NaCl的水溶液能导电,所以NaCl溶液属于强电解质 |
| C、电解熔融NaCl得到23.0g金属钠时能产生22.4 L氯气(标准状况下) |
| D、37Cl 是氯元素的一种同位素,23Na37Cl中质子数和中子数之比是7:8 |


科目:高中化学 来源: 题型:
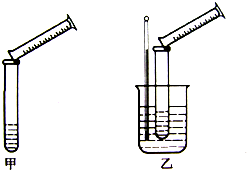 硫代硫酸钠与稀硫酸的反应为:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O.某实验兴趣小组用如下图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略)
硫代硫酸钠与稀硫酸的反应为:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O.某实验兴趣小组用如下图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略) | 实验组号 | 温度 | Na2S2O3 | H2SO4 | 加入H2O 的体积 | 出现沉淀 所需时间 | ||
| 体积 | 浓度 | 体积 | 浓度 | ||||
| Ⅰ | 0℃ | 5mL | 0.1mol/L | 10mL | 0.1mol/L | 5mL | 8s |
| Ⅱ | 0℃ | 5mL | 0.1mol/L | 5mL | 0.1mol/L | 10mL | 12s |
| Ⅲ | 30℃ | 5mL | 0.1mol/L | 5mL | 0.1mol/L | 10mL | 4s |
| Ⅳ | 30℃ | 5mL | 0.2mol/L | 5mL | 0.2mol/L | 10mL | 2s |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④⑤ | B、②③ | C、①③ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
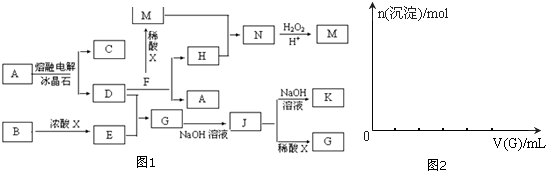
| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
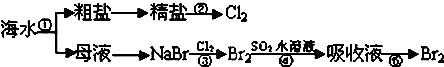
| A、实验室进行①的操作需用到坩埚、玻璃棒、酒精灯 |
| B、②是一个将电能转化为化学能的过程 |
| C、③④⑤涉及的反应均为氧化还原反应 |
| D、NaCl溶液蒸发结晶时,蒸发皿中有大量晶体析出时停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
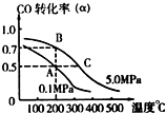 密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)=CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如下图所示.下列说法正确的是( )
密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)=CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如下图所示.下列说法正确的是( )| A、在 A、B两点对应的容器中,n(A)总:n(B)总=4:5 |
| B、在 A、C两点对应的容器中自反应开始到平衡状态所需的时间tA,<tC |
| C、设B、C两点的平衡常数分别为KB、KC,则KB<KC |
| D、在不改变反应物用量的情况下,降温、加压、将甲醇从混合体系中分离出来均可提高CO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
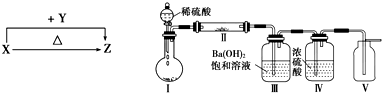
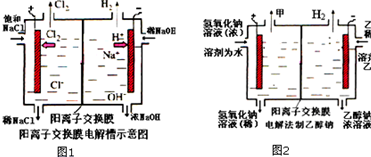 工业上生产氯气,常用电解槽电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分.如图1为电解槽的示意图.
工业上生产氯气,常用电解槽电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分.如图1为电解槽的示意图.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molNa2O和Na2O2的混合物中含有的阴、阳离子总数是3NA |
| B、常温下,1L0.1 mol?L-1的NH4NO3溶液中含有的氮原子数为0.2NA |
| C、46g有机物C2H6O中含有的H-O键的数目为NA |
| D、标准状况下,将0.1molCl2通入足量NaOH溶液中,反应转移的电子数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com