
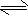 2SO3(g);△H=-197kJ/mol,同温下,往相同体积的密闭容器甲、乙中分别充入
2SO3(g);△H=-197kJ/mol,同温下,往相同体积的密闭容器甲、乙中分别充入 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
(1)在25℃、101kPa下, 1g甲烷完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧热的热化学方程式: 。
(2)2Zn(s)+O2(g)=2ZnO(s) ΔH1 = —702 kJ/mol
2Hg(l)+O2(g)=2HgO(s) ΔH2 = —182 kJ/mol
由此可知ZnO(s)+Hg(l)= Zn(s)+HgO(s)△H3= 。
(3)已知 2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=—99kJ·mol-1.请回答下列问题:
①图中A、C分别表示 、 ,
②E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是
③图中△H= kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)已知2SO2 (g)+ O2(g)2SO3(g) △H =-196kJ·mol-1,5000C时将2mol SO2和1molO2装入一体积恒定的10L密闭容器中,2分钟(t1)时达到平衡。如下图所示:高考
请回答下列问题:
(1)用O2表示2分钟内该反应的平均反应速率为 mol·L-1·min-1。计算500℃时该反应的平衡常数K= 。
(2)上图表示该反应在时刻t1达到平衡后,时刻t2因改变某个条件而发生变化的情况:
图中时刻t2发生改变的条件可能是 (写一个即可)。
(3)在上述条件下起始装入的SO2和O2各2mol,达平衡后设SO2的转化率为x,列出求x的方程 。(不必求出x)
(4)某温度时,该反应的平衡常数K=5000,则该温度 500℃(填“>”、“<”、“=”)。
(5)500℃时,若起始装入的SO2、O2和SO3分别为0.2mol、ymol、wmol,达到平衡时各组分的含量与第(3)完全相同,则y= mol。刚开始时反应向 (填“正”或“逆”)反应方向进行。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省福州文博中学高二上学期期末考试化学试卷(带解析) 题型:单选题
下列依据热化学方程式得出的结论正确的是( )
A.已知2SO2(g)+O2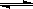 2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量 2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量 |
| B.已知C(石墨,s) ===C(金刚石,s) △H>0,则金刚石比石墨稳定 |
| C.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.4 kJ/mol,则含20 g NaOH的溶液与足量稀盐酸完全反应,放出的热量为28.7 kJ |
| D.已知2C(s) +2O2 (g) ===2CO2(g) △H1 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年天津市武清区杨村一中高二第一次月考化学试卷(带解析) 题型:填空题
(10分)已知:a、H+(aq) + OH-(aq) = H2O(l) △H=-57.3 kJ?mol-1;
b、1.6gCH4完全燃烧生成水蒸气时放热80.2kJ,1g水蒸气转化成液态水放热2.444kJ。
(1)氢氧化钠与硫酸两稀溶液发生反应,写出表征其中和热的热化学方程式:
(2)写出表征甲烷燃烧热的热化学方程式:
(3)已知2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。请回答下列问题: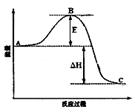
①图中C表示 E的大小对该反应的反应热有无影响? 。
②该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(4)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=―24.8 kJ?mol-1
② 3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H=―47.2 kJ?mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +640.5 kJ?mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014届辽宁省高一下学期期中考试化学试卷(解析版) 题型:选择题
已知2SO2(g)+O2(g)  2SO3(g)(正反应放热)。若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法正确的是
2SO3(g)(正反应放热)。若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法正确的是
A.若降低温度,可以加快反应速率
B.使用催化剂是为了加快反应速率
C.在上述条件下,SO2能完全转化为SO3
D.达到平衡时,SO2和SO3的浓度一定相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com