

分析 (1)在压强相同的条件下,T1对应的吸氢量大,也就是T2→T1,平衡正向移动,而正反应是放热反应,平衡常数是温度的函数,温度不变平衡常数不变,结合表达式分析求解;
(2)①b极质量增加,则b是阴极,所以a是阳极,c是负极、d是正极,通入氢气的电极是负极,所以A是氢气、B是氧气和二氧化碳,d电极上氧气得电子和二氧化碳反应生成碳酸根离子;
②若用该装置电解精炼铜,b是阴极,阴极上发生还原反应得到纯铜;如果是电镀池,铁是阴极,所以阳极为铂;若电镀量较大,需要经常补充或更换的是电解质溶液;
(3)根据盖斯定律①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,②2H2(g)+O2(g)=2H2O(l)△H=-572kJ•mol-1,根据盖斯定律,由②×3-①×2来解答;
(4)①根据化学平衡常数表达式K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$来计算;②根据v=$\frac{△c}{△t}$计算.
解答 解:(1)在压强相同的条件下,T1对应的吸氢量大,也就是T2→T1,平衡正向移动,而正反应是放热反应,所以T2→T1,是降温,所以T2>T1,
a.T1<T2,故a错误;
b.增大氢气压强,反应速率加快,氢气的吸收速率加快,故b正确;
c.M为固体,增大M的量,浓度不变,上述平衡不移动,故c错误;
d.在恒温、恒容容器中,达平衡后充入H2,K=cx(H2),而平衡常数是温度的函数,温度不变,浓度不变,而体积不变,所以物质的量不变,压强不变,故d错误;
故答案为:b;
(2)①b极质量增加,则b是阴极,所以a是阳极,c是负极、d是正极,通入氢气的电极是负极,所以A是氢气、B是氧气和二氧化碳,d电极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为O2+4e-+2CO2=2CO32-,
故答案为:O2+4e-+2CO2=2CO32-;
②若用该装置电解精炼铜,b是阴极,阴极上发生还原反应得到纯铜;如果是电镀池,铁是阴极,所以阳极为铂;若电镀量较大,需要经常补充或更换的是CuSO4溶液,故答案为:精铜;a;CuSO4溶液;
(3)①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
②2H2(g)+O2(g)=2H2O(l)△H=-572kJ•mol-1
根据盖斯定律,由②×3-①×2得:4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-1531.2 kJ•mol-1
故答案为:4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-1531.2 kJ•mol-1;
(4)N2 +3H2?2NH3,
开始(mol):1 3 0
变化(mol):α 3α 2α
平衡(mol):1-α 3-3α 2α
①该反应的平衡常数K=$\frac{(\frac{2a}{10})^{2}}{\frac{1-a}{10}×(\frac{3-3a}{10})^{3}}$=$\frac{400{a}^{2}}{27(1-a)^{4}}$,故答案为:$\frac{400{a}^{2}}{27(1-a)^{4}}$;
②从反应开始到平衡时N2的消耗速率v(N2)=$\frac{△c}{△t}$=$\frac{\frac{a}{10}}{5min}$=0.02αmo1•L-1•min-1,故答案为:0.02α.
点评 本题是道综合题,三段式法对化学反应进行计算,注意化学平衡常数、转化率等知识的运用,难度不大,涉及知识点较多,注意对应知识的积累.


科目:高中化学 来源: 题型:选择题
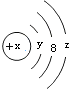
| A. | Y=2 | B. | 若X=14,它的氢化物的化学式为H2X | ||
| C. | 若X=18,则Z=8 | D. | 若X=17,它的氧化物化学式为W2O7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
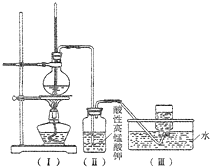 如图,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后溶液中出现棕色、黑色现象.过一段时间后,发现硫酸酸化的高锰酸钾溶液褪色.甲同学认为酸性高锰酸钾溶液褪色,能证明乙烯被酸性高锰酸钾溶液氧化了;乙同学认为酸性高锰酸钾溶液褪色,不能证明乙烯被酸性高锰酸钾溶液氧化了.
如图,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后溶液中出现棕色、黑色现象.过一段时间后,发现硫酸酸化的高锰酸钾溶液褪色.甲同学认为酸性高锰酸钾溶液褪色,能证明乙烯被酸性高锰酸钾溶液氧化了;乙同学认为酸性高锰酸钾溶液褪色,不能证明乙烯被酸性高锰酸钾溶液氧化了.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
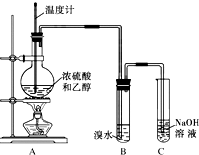 为探究乙烯的制取及乙烯和溴水反应的有关问题,甲、乙、丙三同学进行了如下实验活动,请你参与他们的活动并回答相关问题.
为探究乙烯的制取及乙烯和溴水反应的有关问题,甲、乙、丙三同学进行了如下实验活动,请你参与他们的活动并回答相关问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应是放热反应 | |
| B. | 断裂2 mol A-B 键需要吸收y kJ的能量 | |
| C. | 断裂1 mol A-A 键和1 mol B-B 键放出x kJ能量 | |
| D. | 1 mol A2和1 mol B2的总能量高于2 mol AB的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图装置,用电化学原理制备硫酸,并电解500mL 0.2mol?L-1AgNO3溶液.请回答下列问题:
如图装置,用电化学原理制备硫酸,并电解500mL 0.2mol?L-1AgNO3溶液.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com