
某学生利用以下装置探究喷泉实验。其中A、F分别为硫化氢和氯气的发生装置,C为纯净干燥的氯气与硫化氢反应的装置。
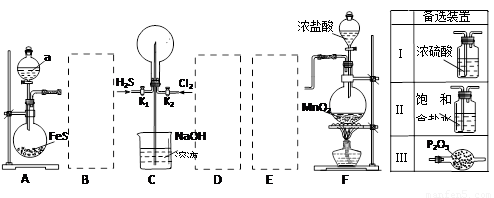
请回答下列问题:
(1)装置F中发生反应的化学方程式 。
(2)装置A中的分液漏斗内液体a可选用 (选填以下选项的代号)
A.盐酸 B.浓硫酸 C.稀硫酸 D.稀硝酸
(3)虚线框内应添加必要的除杂装置,请从上图的“备选装置”中选择合适装置的编号,填入下列空格。B__________、D__________、E__________。
(4)打开K1、K2,将常温压下的H2S、Cl2以体积比1:1充满烧瓶后,烧瓶中发生的反应用化学方程式表示为 ;关闭K1、K2,始终看不到烧瓶内产生“喷泉”现象,理由是: 。
(5)在操作(4)的基础上,引发喷泉操作方法是 。
(1)(共3分)MnO2 + 4HCl(浓)  MnCl2
+ Cl2↑ + 2H2O
MnCl2
+ Cl2↑ + 2H2O
(2)(共2分)AC
(3)(共3分)Ⅲ、Ⅰ、Ⅱ
(4)(共5分)H2S+Cl2=2S+2HCl;(3分,化学式2分,配平1分) 烧瓶内的气压与外界气压相同(1分),不能产生压强差,故无喷泉现象(1分)。
(5)(共3分)方法① 用手(或热毛巾)将烧瓶捂热或将烧瓶微热(1分),烧瓶内气体受热膨胀(即增大压强,1分),使HCl与烧杯中溶液接触,即可引发喷泉(1分);
方法② 用冰水或其它制冷剂浇在烧瓶上(给烧瓶降温,1分),以减小烧瓶内气体的压强,(1分)烧杯中溶液通过导管进入烧瓶内与HCl气体接触,即可引发喷泉(1分)。
|
试题分析:(1)装置F为制取氯气的发生装置,所以发生的反应方程式为:MnO2 + 4HCl(浓) === MnCl2 + Cl2↑ + 2H2O 。
(2)装置A为制取H2S的发生装置,利用强酸和硫化物反应制得,但是硫化物中的S有较强还原性,不能用强化性的酸制备,所以不能用浓硫酸、稀硝酸,故选AC。
(3)虚线框B为H2S气体的干燥装置,不能用强氧化性的的浓硫酸干燥,所以选五氧化二磷装置Ⅲ;虚线框D、E分别为氯气的除杂装置和干燥装置,D用装置Ⅱ饱和食盐水可以除去杂质HCl,用装置Ⅰ浓硫酸可以除去水蒸气。
(4)H2S、Cl2以体积比1:1充满烧瓶,则发生的氧化还原反应按照1:1反应,所以方程式为:H2S+Cl2=2S+2HCl。观察方程式可得知反应中前后气体系数不变,所以反应前后气体压强不变,烧瓶内的气压与外界气压相同,不会造成压强差,不能形成喷泉。
(5)要使上述实验产生喷泉现象,必须要让烧瓶内的气压和外界气压产生压强差,所以可以采取升温或冷却的方法:方法① 用手(或热毛巾)将烧瓶捂热或将烧瓶微热,烧瓶内气体受热膨胀,使HCl与烧杯中溶液接触,即可引发喷泉;方法② 用冰水或其它制冷剂浇在烧瓶上,以减小烧瓶内气体的压强,烧杯中溶液通过导管进入烧瓶内与HCl气体接触,即可引发喷泉
考点:本题考查的是氯气、硫化氢气体的实验室制备以及喷泉实验的原理。


科目:高中化学 来源: 题型:

| ||
| ||
| b |
| 2a |
| b |
| 2a |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com