
| A. | 钠在空气中露置会立刻被空气氧化成过氧化钠 | |
| B. | 钠单质具有强还原性,可将铜从其盐溶液中置换出来 | |
| C. | 钠与钠离子都具有强的还原性 | |
| D. | 钠与稀盐酸反应的实质是与氢离子的反应 |
分析 A.钠露置在空气中易被氧气氧化为氧化钠;
B.钠与盐溶液反应,先与水反应;
C.钠原子具有强还原性,钠离子没有还原性;
D.钠与盐酸反应生成氢气和氯化钠.
解答 解:A.常温下,钠露置在空气中易被氧气氧化为氧化钠,因此应保存在煤油里,钴A错误;
B.钠与盐溶液反应,先与水反应,所以钠性质虽然活泼,但是不能从盐溶液中制取金属,故B错误;
C.钠原子最外层只有一个电子,极易失电子而具有强还原性,钠离子最外层达到8电子稳定结构,所以没有还原性,故C错误;
D.钠与盐酸反应生成氢气和氯化钠,所以钠与酸反应就是与酸电离出的氢离子反应,故D正确;
故选D.
点评 本题考查了钠,熟悉钠的化学性质是解题关键,其中钠离子最外层达到8电子稳定结构,所以没有还原性.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:解答题
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 12.60 | 18.90 | 28.00 |
| 二氧化硫的体积/L | 1.12 | 1.68 | 2.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
铁及其化合物在生活、生产中有广泛应用.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
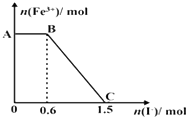
| A. | 图中AB段的氧化剂为K2Cr2O7 | |
| B. | 图中BC段发生的反应为2Fe3++2I-═2Fe2++I2 | |
| C. | 开始加入的K2Cr2O7为0.25 mol | |
| D. | 若将上述过程中的KI溶液换为K3[Fe(CN)6]溶液,则有蓝色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
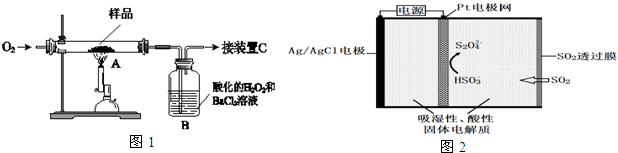
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
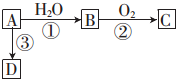 已知A 是一种相对分子质量为28 的气态烃,它可转化为其他常见有机物.转化关系如图所示.
已知A 是一种相对分子质量为28 的气态烃,它可转化为其他常见有机物.转化关系如图所示.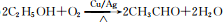 .
.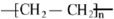 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3溶液 | B. | 稀硫酸 | C. | 酚酞 | D. | Ba(OH)2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com