
| A. | 用长颈漏斗分离出乙酸与乙醇反应的产物 | |
| B. | 用向上排空气法收集铜粉与稀硝酸反应产生的NO | |
| C. | 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2 | |
| D. | 配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释 |
分析 A.乙酸与乙醇反应的产物互溶,不分层;
B.NO与氧气反应,不能利用排空气法收集;
C.食盐水不能干燥氯气;
D.盐酸可抑制铁离子的水解.
解答 解:A.乙酸与乙醇反应的产物互溶,不分层,则分液漏斗不能分离,应选饱和碳酸钠溶液反应后分液,故A错误;
B.NO与氧气反应,不能利用排空气法收集,则应选排水法收集铜粉与稀硝酸反应产生的NO,故B错误;
C.将Cl2与HCl混合气体通过饱和食盐水除去HCl,再利用浓硫酸干燥可得到纯净的Cl2,故C错误;
D.盐酸可抑制铁离子的水解,则配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、混合物分离、盐类水解为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | O=O | O-H |
| 能量(kJ) | 436 | a | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,VLCO和H2的混合气体,完全燃烧消耗O2的体积为$\frac{V}{2}$L | |
| B. | 已知某氢氧化钠溶液中Na+与H2O的个数之比为1:a,则可求出此溶液中氢氧化钠的质量分数 $\frac{2000}{20+9a}$% | |
| C. | 4.2g氮气和4.8g某单质RX所含原子个数相同,且分子个数之比为1:1,则R的相对原子质量为16 | |
| D. | 在10%的NaOH溶液中,平均每9个水分子溶有1个OHˉ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是物质的数量单位 | |
| B. | 氢气的摩尔质量是2g | |
| C. | 1mol OH-的质量是17g | |
| D. | 气体摩尔体积就是1mol气体所占的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑦⑧ | B. | ③⑥⑦ | C. | ③⑥⑦⑧ | D. | ①②③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
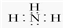 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大理石与醋酸反应:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| B. | 硅与NaOH溶液反应:Si+2OH-+H2O═SiO32-+2H2↑ | |
| C. | 水玻璃与醋酸反应:SiO32-+2H+═H2SiO3↓ | |
| D. | 硅石与烧碱溶液反应:SiO2+2OH-═SiO32-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com