
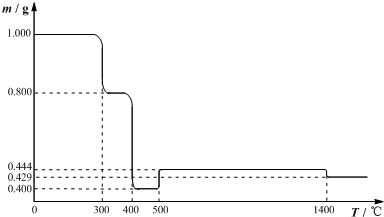
分析 (1)根据图象,300℃时是样品脱水生成固体质量为0.800g,所以假设反应为:
FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeC2O4•(2-n)H2O+nH2O
180 18n
1.000g (1.000-0.800)g
解得n=2,所以350℃时样品完全脱水;
(2)根据铁元素质量守恒,铁原子的最小公倍数是6,于是存在下列质量关系:
6FeO→3Fe2O3→2Fe3O4
72:80:77.3
固体质量的变化趋势与表中提供的数据一致.即72:80:77.3≈0.400:0.444:0.429.
因此表明:FeC2O4分解时,先转变为FeO,再转变为Fe2O3,最后变为Fe3O4,所以400℃时FeC2O4分解生成FeO,结合化合价有升必有降,则还有一氧化碳和二氧化碳生成;
(3)根据(2)的分析,600℃时FeC2O4分解生成Fe2O3,加稀盐酸溶解生成三价铁溶液,根据三价铁易水解成酸性分析;根据Ksp[Fe(OH)3]=4.0×10-38进行计算;
(4)根据取少量该溶液滴加KSCN,溶液显血红色,说明含有三价铁离子;另取少量该溶液滴加K3[Fe(CN)6](铁氰化钾)溶液,产生特征蓝色沉淀,说明含有二价铁离子,所以根据氧化还原反应的特征1 400℃时Fe2O3发生分解生成Fe3O4和氧气;产生特征蓝色沉淀的离子反应方程式3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓.
解答 解:(1)根据图象,300℃时是样品脱水生成固体质量为0.800g,所以假设反应为:
FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeC2O4•(2-n)H2O+nH2O
180 18n
1.000g (1.000-0.800)g
解得n=2,所以350℃时样品完全脱水;
故答案为:是;
推算过程:
FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeC2O4•(2-n)H2O+nH2O
180 18n
1.000g (1.000-0.800)g
解得n=2,所以350℃时样品完全脱水;
(2)根据铁元素质量守恒,铁原子的最小公倍数是6,于是存在下列质量关系:
6FeO→3Fe2O3→2Fe3O4
72:80:77.3
固体质量的变化趋势与表中提供的数据一致.即72:80:77.3≈0.400:0.444:0.429.
因此表明:FeC2O4分解时,先转变为FeO,再转变为Fe2O3,最后变为Fe3O4,所以400℃时FeC2O4分解生成FeO,结合化合价有升必有降,则还有一氧化碳和二氧化碳生成;反应方程式为:FeC2O4$\frac{\underline{\;400℃\;}}{\;}$FeO+CO↑+CO2↑;故答案为:FeC2O4$\frac{\underline{\;400℃\;}}{\;}$FeO+CO↑+CO2↑;
(3)根据(2)的分析,600℃时FeC2O4分解生成Fe2O3,加稀盐酸溶解生成三价铁溶液,因为三价铁易水解所以溶液的PH为3,水解方程式为:Fe3++3H2O?Fe(OH)3+3H+;当铁元素的离子浓度为4.0×10-11 mol•L-1,则氢氧根的浓度为:$\root{3}{\frac{4×1{0}^{-38}}{4×1{0}^{-11}}}$=1.0×10-9 mol•L-1,氢离子浓度为$\frac{1×1{0}^{-14}}{1×1{0}^{-9}}$=1.0×10-5 mol•L-1,所以PH=5,故答案为:Fe3++3H2O?Fe(OH)3+3H+;5;
(4)根据取少量该溶液滴加KSCN,溶液显血红色,说明含有三价铁离子;另取少量该溶液滴加K3[Fe(CN)6](铁氰化钾)溶液,产生特征蓝色沉淀,说明含有二价铁离子,所以根据氧化还原反应的特征1 400℃时Fe2O3发生分解生成Fe3O4和氧气;产生特征蓝色沉淀的离子反应方程式3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓;故答案为:6Fe2O3$\frac{\underline{\;1400℃\;}}{\;}$4Fe3O4+O2↑;3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓.
点评 本题考查了探究物质组成、测量物质含量及性质实验方案的设计,题目难度中等,注意掌握物质的性质及检验方法,正确分析曲线变化为解答本题的关键,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化物是指含氧元素的化合物 | B. | 氧化物、酸、碱、盐都含氧元素 | ||
| C. | 碱性氧化物一定是金属氧化物 | D. | 酸性氧化物一定是非金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一试管中加入2mL5%H2O2和1mLH2O,向另一试管中加入2mL 10%H2O2和1mLFeCl3溶液,观察并比较实验现象 | |
| B. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量饱和碳酸钠溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 检验溶液中是否含有Fe3+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象 | |
| D. | 制备Al(OH)3悬浊液:向1mol•L-1AlCl3溶液中加过量的6mol•L-1NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
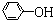 )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子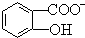 能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是
能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是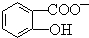 中形成分子内氢键,使其更难电离出H+.
中形成分子内氢键,使其更难电离出H+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
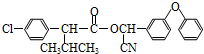 )
)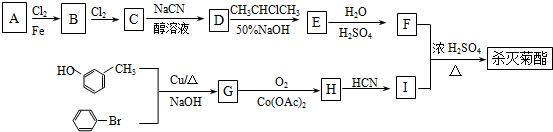
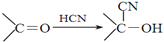
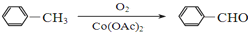
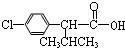 +
+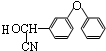 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$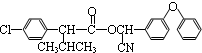 +H2O.
+H2O.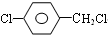 +3NaOH$→_{△}^{H_{2}O}$2NaCl+H2O+
+3NaOH$→_{△}^{H_{2}O}$2NaCl+H2O+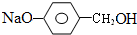 .
.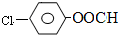 结构,则符合此条件的F共有8种.
结构,则符合此条件的F共有8种.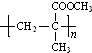 (用合成路线流程图表示,并注明反应条件).
(用合成路线流程图表示,并注明反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 实验目的 | |
| A | 将潮湿的NH3通过盛有无水CaCl2的干燥管 | 除去NH3中的水蒸气 |
| B | 往铁和稀硝酸反应后的溶液中滴入KSCN溶液 | 验证溶液中是否含有Fe3+ |
| C | 甲基橙作指示剂,用标准NaOH溶液滴定盐酸至红色 | 测量盐酸物质的量浓度 |
| D | 向2ml0.2mol/L的AgNO3溶液中先后滴加0.2mol/L 的NaCl溶液、KBr溶液各5滴 | 确定AgCl、AgBr的Kap的相对大小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com