
| A. | 氯气的摩尔质量为71 | |
| B. | 已知Fe(OH)3胶粒带正电,向氢氧化铁胶体中滴加NaHSO4溶液至过量,最终能得到Fe(OH)3沉淀 | |
| C. | 2L 1mol/LAlCl3溶液中,Cl-物质的量浓度为3mol/L | |
| D. | 阿伏加德罗常数的数值就是0.012kg碳中含有的碳原子数目 |
分析 A.摩尔质量的单位为g/mol;
B.硫酸氢钠电离出的氢离子与氢氧化铁反应,无法达到氢氧化铁沉淀;
C.根据c(Cl-)=3c(AlCl3)计算;
D.碳元素存在多种同位素,必须指出12C.
解答 解:A.氯气的摩尔质量为71g/mol,故A错误;
B.Fe(OH)3与NaHSO4溶液电离出的氢离子发生中和反应,无法达到Fe(OH)3沉淀,故B错误;
C.2L 1mol/LAlCl3溶液中,Cl-物质的量浓度为:c(Cl-)=3c(AlCl3)=3mol/L,故C正确;
D.1mol任何粒子的粒子数与0.012kg 12C中含有的碳原子数目相同,没有指出0.012kg 12C,故D错误;
故选C.
点评 本题考查较为综合,涉及胶体性质、摩尔质量与相对分子质量、阿伏伽德罗常数、物质的量浓度的计算等知识,题目难度不大,B为易错点,注意硫酸氢钠呈强酸性,试题培养了学生的灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | Na+、Ca2+、Cl-、NO3- | B. | Fe3+、K+、Cl-、HCO3- | ||
| C. | Cu2+、Na+、Cl-、SO42- | D. | K+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
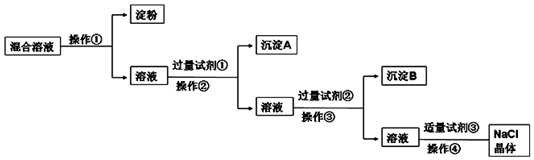
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO42- 0.1 mol•L-1 | B. | Al3+ 0.2 mol•L-1 | ||
| C. | Cl- 0.3 mol•L-1 | D. | K+ 0.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用量筒量取KMnO4溶液12.00mL | |
| B. | 测定中和热时将NaOH溶液迅速一次性倒入盛有盐酸的小烧杯中,盖好盖板 | |
| C. | 常温下,测得0.01mol/LNaHCO3溶液的pH值=12 | |
| D. | 加热蒸发FeCl3溶液,获得FeCl3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=185.57 kJ•mol-1能自发进行,是因为体系有自发地向混乱度增大的方向转变的倾向 | |
| B. | 能自发进行的反应一定能迅速发生 | |
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独做为判断反应能否自发进行的判据 | |
| D. | CaCO3(s)═CaO(s)+CO2(g)△H>0,△S>0,不论在何种条件下都可能自发 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 平行实验编号 | Na2C2O4溶液 (mL) | 滴定管起始读数(mL) | 滴定管滴定终点读数(mL) |
| 1 | 20.00 | 0.00 | 21.18 |
| 2 | 20.00 | 1.02 | 21.00 |
| 3 | 20.00 | 1.18 | 21.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com