
| A. | Na2CO3 | B. | NaHCO3 | C. | Na2CO3、NaHCO3 | D. | Na2CO3、NaOH |
分析 若只发生:CO2+2NaOH=Na2CO3+H2O,计算生成Na2CO3的质量,若只发生:CO2+NaOH=NaHCO3,计算生成NaHCO3的质量,再与最终得到固体1.0g比较,判断固体组成.
解答 解:NaOH物质的量为$\frac{0.8g}{40g/mol}$=0.02mol,
若只发生:CO2+2NaOH=Na2CO3+H2O,则生成0.01mol的Na2CO3,质量=0.01mol×106g/mol=1.06g;
若只发生:CO2+NaOH=NaHCO3,则生成0.02mol的NaHCO3,其质量=0.02mol×84g/mol=1.68g,
由于1.68g>1.06g>1.0g,所以得到的固体是Na2CO3和NaOH,
故选:D.
点评 本题考查化学方程式有关计算,题目难度中等,注意利用极限法进行分析解答.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:选择题
| A | B | C | ||
| D | E | F | G |
| A. | 氧化物对应的水化物的酸性:G一定强于F | |
| B. | 简单离子的半径:F>G>C>D | |
| C. | 1mol EC2中含2mol E-C键 | |
| D. | A、G分别与氢元素形成的化合物中,化学键均为极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大 | |
| B. | 反应MgCl2(l)=Mg(l)+Cl2(g)的△H<0△S>0 | |
| C. | 等浓度的系列稀溶液:①硫酸氢钠②乙酸钠③醋酸④碳酸氢钠,它们的PH由小到大排列的为③①④② | |
| D. | 0.1mol•L-1 Na2SO3溶液中:c(OH-)-c(H+)═2 c(H2SO3)+c(HSO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Fe2+、NO${\;}_{3}^{-}$、Na+ | B. | Ag+、NO3-、Cl-、K+ | ||
| C. | K+、Ba2+、OH-、SO42- | D. | Cu2+、NH4+、Br-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 探究Fe3+和Cu2+对H2O2分解的催化效果
探究Fe3+和Cu2+对H2O2分解的催化效果| 实验序号 | 5% H2O2溶液的体积(mL) | 选用试剂 | 选用试剂体积(mL) | 收集V mL O2所需时间(min) |
| ① | 10 | 蒸馏水 | 5 | m |
| ② | 10 | 0.1mol/L CuSO4 | v1 | n |
| ③ | 10 | 试剂M | 5 | p |
| ④ | 10 | 0.1mol/L Na2SO4 | 5 | m |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
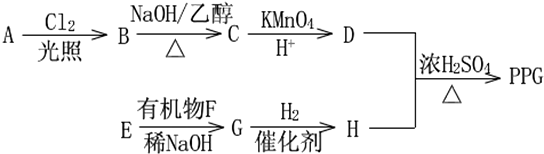

 .
. .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液使SO42-反应完全:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O | |
| C. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用物质A表示的反应的平均速率为0.3 mol•L-1•s-1 | |
| B. | 2s时的压强是起始时的1.1倍 | |
| C. | 2s时物质A的转化率为30% | |
| D. | 2s时物质B的浓度为0.7mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com