
| A. | 泡沫灭火器利用硫酸铝和小苏打溶液反应的产物来灭火 | |
| B. | 为使水果尽快成熟,可用浸泡过高锰酸钾溶液的硅土吸收水果产生的乙烯 | |
| C. | 煤的干馏、燃煤烟气的脱硫、煤的液化和气化等过程都是化学变化 | |
| D. | 面粉生产中禁止添加的过氧化钙(CaO2)阴、阳离子的个数之比为1:1 |
分析 A.Al2(SO4)3和小苏打反应,相互促进水解生成二氧化碳气体;
B.乙烯具有催熟作用,能被高锰酸钾氧化;
C.煤的干馏、燃煤烟气的脱硫、煤的液化和气化都是化学变化;
D.过氧化钙构成离子是钠离子和过氧根离子.
解答 解:A.Al2(SO4)3和小苏打反应,相互促进水解生成二氧化碳气体,可灭火,故A正确;
B.乙烯具有催熟作用,能被高锰酸钾氧化,用浸泡过高锰酸钾溶液的硅土吸收水果产生的乙烯,是为了延长水果的成熟期,故B错误;
C.煤的干馏是将煤隔绝空气加强热使其分解的过程;燃煤烟气中的二氧化硫用碱性溶液吸收;煤的液化是用煤制取甲醇的过程,煤的气化是用煤制取CO和氢气的过程,均为化学变化,故C正确;
D.过氧化钙构成离子是钠离子和过氧根离子,则CaO2中阴阳离子的个数比为1:1,故D正确;
故选B.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应、性质与用途为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | FeCl2溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- | |
| B. | FeS固体放入稀硝酸溶液中:FeS+2H+=Fe2++H2S↑ | |
| C. | 碳酸氢镁和足量的氢氧化钙溶液反应:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| D. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使Al3+沉淀完全:2Al3++3SO42-+3Ba2++6OH-=2 Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
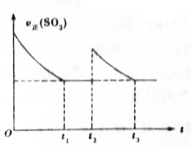 一定温度下,密闭容器中进行反应:2SO2(g)+O2(g)?2SO3(g)△H<0.测得v正(SO2)随反应时间(t)的变化如图所示.下列有关说法正确的是( )
一定温度下,密闭容器中进行反应:2SO2(g)+O2(g)?2SO3(g)△H<0.测得v正(SO2)随反应时间(t)的变化如图所示.下列有关说法正确的是( )| A. | t2时改变的条件是:只加入一定量的SO2 | |
| B. | t1时平衡常数K1大于t3时平衡常数K2 | |
| C. | t1时平衡混合气的$\overline{{M}_{1}}$大于t3时平衡混合气的$\overline{{M}_{2}}$ | |
| D. | t1时平衡混合气中的SO3的体积分数等于t3时平衡混合气中SO3的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无水乙酸和乙醇共热制取乙酸乙酯 | |
| B. | 将苯逐滴滴入浓硝酸中,并用沸水浴加热制取硝基苯 | |
| C. | 将铜丝在酒精灯上加热后,立即伸人无水乙醇中,铜丝恢复原来的红色 | |
| D. | 淀粉用酸催化水解后的溶液加入新制银氨溶液,水浴加热,可看到有银镜出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C6H12O6(葡萄糖aq)+6O2$\stackrel{酶}{→}$6CO2+6H2O | |
| B. | CH3COOH+KOH═CH3COOK+H2O | |
| C. | A+B═C+D;△H<0 | |
| D. | Ba(OH)2•8H2O与NH4Cl反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ②④⑤ | C. | ②③④⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
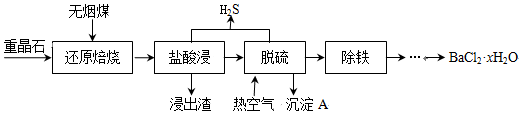
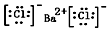 .
.| AgCl | AgI | Ag2CrO4 | |
| Ksp | 2×10-10 | 8.3×10-17 | 2×10-12 |
| 颜色 | 白 | 黄 | 砖红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com